
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон действующих масс. Константа химического равновесия
|
|
|
|
Термодинамика химического равновесия. Константа химического равновесия. Закон действующих масс. Принцип Ле-Шателье. Изотерма химической реакции. Равновесие в гетерогенных реакциях. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции.
Cуществуют реакции, протекающие в двух противоположных направлениях, которые называются обратимыми
Н2 газ + I2 газ 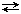 2 НIгаз
2 НIгаз
С течением времени скорость (V) прямой реакции, которая пропорциональна произведению концентраций исходных веществ, будет уменьшаться, так как уменьшаются концентрации исходных веществ (Н2 и I2), а скорость обратной реакции, которая пропорциональна концентрации НI в квадрате, увеличивается, так как увеличивается концентрация НI. Наконец, наступит такой момент, когда Vпрямой = Vобратной, т. е. наступает состояние химического равновесия.
Устойчивые равновесия (в том числе и химические) характеризуются следующими общими признаками:
1. Неизменностью равновесного состояния системы при сохранении внешних условий.
2. Подвижностью равновесия
3. Динамическим характером равновесия, т.е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов.
4. Возможностью подхода к состоянию равновесия с двух противоположных сторон (т.е. вводя только исходные вещества, либо только продукты реакции).
5. Минимальным значением G (или F или соответствующим экстремальным значением другой характеристической функции при иных путях проведения процесса).
Можно вывести конкретные условия равновесия, одним из которых является закон действующих масс (закон действия масс), который был выведен кинетическим способом Гульдбергом и Вааге в 1867 г. (кинетический метод менее строгий, чем термодинамический).
Кинетический вывод закона действующих масс.
Рассмотрим обратимую реакцию:
Н2 газ + I2 газ 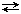 2 НIгаз
2 НIгаз
Для прямой реакции при постоянной температуре скорость реакции равна:
Vпрямой = k1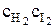
Для обратной реакции скорость равна:
Vобратной = k2с2HI
Это математическая форма записи так называемого основного постулата химической кинетики. Здесь k1 и k2 – константы скорости прямой и обратной реакции.
При равновесии: Vпрямой = Vобратной, т.е
. 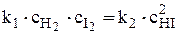 ,
,
откуда 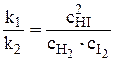 или
или 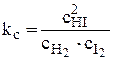 ,
,
где 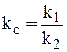 .
.
Здесь kс – константа равновесия, выраженная через равновесные концентрации (ее иногда называют классической константой равновесия или концентрационной константой равновесия). Это и есть математическое выражение закона действующих масс для рассмотренной реакции, который формулируется следующим образом:
отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная для данной реакции.
Термодинамическая константа равновесия.
Химические реакции обратимы и могут протекать как в прямом так и в обратном направлении.
В случае реальных систем равновесные концентрации заменяют на равновесные активности (а i) и получают термодинамическую константу химического равновесия:
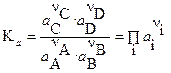 ,
,
где n i – стехиометрические коэффициенты уравнения реакции. Величины 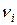 положительны для продуктов реакции и отрицательны для исходных веществ.
положительны для продуктов реакции и отрицательны для исходных веществ.
Константы химического равновесия, выраженные через равновесные парциальные давления р i или равновесные фугитивности f i участников реакции, имеют вид:
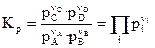 ,
,
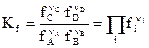 .
.
Один из важных выводов из закона действия масс является взаимосвязь парциальных давлений (или концентраций) всех веществ, участвующих в реакции. В условиях равновесия парциальные давления (или концентрации) всех веществ, участвующих в реакции, связаны между собой. Нельзя изменить парциальное давление (или концентрации) ни одного из них, без изменения парциальных давлений (или концентраций) всех остальных веществ, участвующих в реакции, чтобы сохранилось прежнее численное значение константы равновесия при данных условиях.
Пример 3.1 Процесс получения хлора окислением хлористого водорода протекает по уравнению:
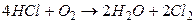 .
.
При смешении 1 моль HCl с 0,48 моль O 2 образуется 0,402 моль Cl 2. В системе P = 1 атм (1,013*105 Па), T =659 K. Найти значение K P.
Решение. На образование 0.402 моль Cl 2 расходуется 0.804 моль HCl и 0,201 моль O 2. При установлении в системе равновесия имеем:

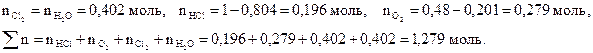
Найдем равновесные парциальные давления участников реакции:
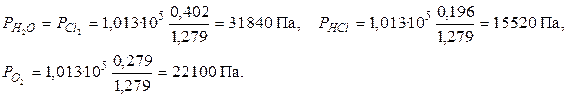
Рассчитаем константу равновесия реакции:
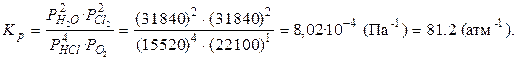
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 565; Нарушение авторских прав?; Мы поможем в написании вашей работы!