
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия равновесия для химической реакции
|
|
|
|
Рассмотрим реакцию: N2 газ + 3 Н2 газ 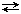 2 NН3 газ протекающую при р, Т = const. Изменения количеств веществ в результате химической реакции связаны между собой. Пусть изменение числа молей N2 будет –0,2 моль; тогда изменение чисел молей (
2 NН3 газ протекающую при р, Т = const. Изменения количеств веществ в результате химической реакции связаны между собой. Пусть изменение числа молей N2 будет –0,2 моль; тогда изменение чисел молей ( Dn) Н2 и NH3, будет, соответственно: –3×0,2-0,6 и 2×0,2=0,4моль. Таким образом видно, что
Dn) Н2 и NH3, будет, соответственно: –3×0,2-0,6 и 2×0,2=0,4моль. Таким образом видно, что 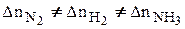
Но отношения 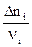 будут одинаковыми для всех участников реакции.
будут одинаковыми для всех участников реакции.
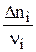 =
= 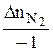 =
= 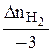 =
= 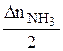 = 0,2
= 0,2
При этом принято, что ni > 0 – для продуктов реакции, ni < 0 – для исходных веществ.
Величина 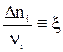 называется степенью полноты протекания реакции, химической переменной или числом пробегов реакции.
называется степенью полноты протекания реакции, химической переменной или числом пробегов реакции.
Для любой химической реакции:
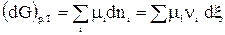 , (1)
, (1)
где 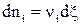 (ξ – химическая переменная).
(ξ – химическая переменная).
Можно показать, что если mi = сonst (т.е. если состав системы не меняется), то после интегрирования уравнения (1) получается
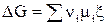
(ni > 0 – для продуктов, ni < 0 – для исходных веществ).
Для одного пробега реакции, т.е. в случае, когда ξ = 1 (когда прореагировали вещества в количествах, равных их стехиометрическим коэффициентам: Dni = ni), в условиях постоянного состава системы (в условиях бесконечно большого количества всех компонентов, когда химический потенциал mi = сonst) изменение энергии Гиббса равно:
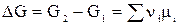 или
или
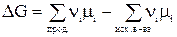
Проанализируем последнее выражение.
1) Если DG < 0, то
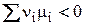 (2)
(2)
В этом случае реакция может протекать самопроизвольно слева направо при постоянных температуре и давлении.
2) Пусть DG > 0, тогда
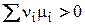 (3)
(3)
В этом случае реакция может протекать самопроизвольно справа налево при постоянных температуре и давлении.
3) Пусть DG = 0, тогда
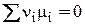 (4)
(4)
Система находится в состоянии равновесия.
Условия (2–4) – условия направленности и равновесия процессов для любой химической реакции.
Стандартные условия протекания реакции.
В термодинамике под стандартными условиями понимают, что начальные активности всех компонентов a i равны единице, т.е. все a i = 1 (в случае идеальных газов это будет, когда все рi = 1 атм), причем начальные количества веществ будут настолько велики (бесконечно большие), что их изменение в результате протекания 1 пробега химической реакции не скажется на изменении состава исходной смеси, т.е. на протяжении реакции активности всех компонентов останутся постоянными и равными единице.
Тогда mi = mi0 (поскольку mi = mi0 + RT ln a i). В результате получим:
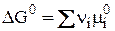 (5)
(5)
(ni > 0 – для продуктов, ni < 0 – для исходных веществ).
При равновесии будем иметь:
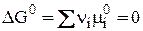 , (6)
, (6)
DG0 – стандартное изменение энергии Гиббса в результате одного пробега химической реакции, протекающей при описанных выше стандартных условиях, (причем не тогда, когда робщ. = 1 атм, а когда рi всех участников реакции равны 1 атм и постоянны).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 354; Нарушение авторских прав?; Мы поможем в написании вашей работы!