
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изотерма химической реакции
|
|
|
|
Уравнение изотермы (или просто изотерма) химической реакции позволяет связать возможное направление химической реакции с исходным составом реагирующих веществ. Уравнение изотермы химической реакции легко получить, используя следующие соотношения:
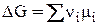
mi = mi0 + RTln a i, (7)
где а i – начальная активность i-ого компонента.
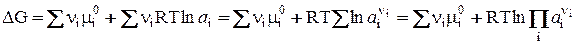 (8)
(8)
Но 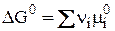 ;
;
поэтому  .
.
В уравнении изотермы химической реакции единицы измерения R = 8,314  , [DG] = [DG0] = Дж.
, [DG] = [DG0] = Дж.
Здесь DG – изменение энергии Гиббса для одного пробега реакции при заданных температуре и давлении и постоянном составе системы (когда количества всех веществ взяты бесконечно большими и их начальные активности заданы равными a i)
DG0 – стандартное изменение энергии Гиббса для одного пробега той же реакции, если начальные активности равны единице.
Если задать начальные активности каждого из участников реакции равными их соответствующим равновесным активностям, то система (реакция) будет находиться в состоянии равновесия, поэтому DG = 0, и из уравнения изотермы получим:
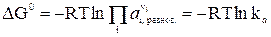 (9)
(9)
где  (10)
(10)
или (11)
(11)
(здесь ni > 0 – для продуктов, ni < 0 – для исходных веществ).
DG0 = –RT lnk a (12)
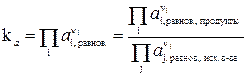
тогда 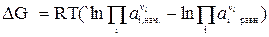 (13)
(13)
Для процессов, протекающих при постоянных объеме и температуре, можно получить аналогичное выражение для энергии Гельмгольца, подставив вместо a i концентрацию сi:
 (14)
(14)
где 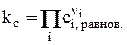 (15)
(15)
По уравнению изотермы химической реакции (11) с учетом соотношения (13) можно определить направление протекания химической реакции при заданных начальных концентрациях (парциальных давлениях) участников реакции и, например, при постоянных давлении и температуре.
Рассмотрим уравнение изотермы химической реакции в виде:
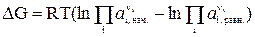 , (16)
, (16)
Может быть три случая:
1)  . Следовательно DG < 0. В системе термодинамически возможно самопроизвольное протекание прямой реакции при указанных выше условиях.
. Следовательно DG < 0. В системе термодинамически возможно самопроизвольное протекание прямой реакции при указанных выше условиях.
2) 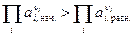 . Следовательно DG > 0. В этом случае термодинамически возможно самопроизвольное протекание обратной реакции.
. Следовательно DG > 0. В этом случае термодинамически возможно самопроизвольное протекание обратной реакции.
3) 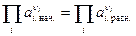 . Следовательно DG = 0. Данная система будет находиться в состоянии химического равновесия.
. Следовательно DG = 0. Данная система будет находиться в состоянии химического равновесия.
Из анализа уравнения изотермы химической реакции видно, что, меняя начальные концентрации (парциальные давления) веществ, в принципе, можно менять и направление протекания реакции.
Иногда в качестве критерия приближенной оценки возможности протекания реакции используют не величину DG, а величину DG0, которую можно рассчитать на основании термодинамических характеристик участников реакции:
DG0Т = DH0Т – ТDS0T;
DH0T = DH0298 + DС0р, 298 (Т – 298); (17)
DS0T = DS0298 + DС0р, 298 ln . (18)
. (18)
3.4 Связь между kр и kс.
Если рассматривать обратимую газовую реакцию и считать газы идеальными, то выполняются следующие соотношения:
1) Закон Менделеева–Клапейрона pV = nRT (или piV = niRT).
 , где
, где  , (19)
, (19)
Отсюда можно получить следующие соотношения, показывающие взаимосвязь между kр и kс
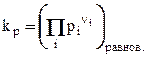 , но т.к. pi = ciRT, то получим:
, но т.к. pi = ciRT, то получим:
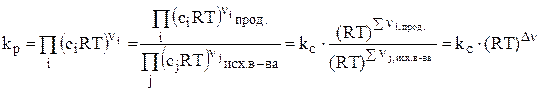 .
.
Здесь Dn – изменение числа молей газообразных веществ в результате протекания одного пробега данной реакции.  (20)
(20)
kр = kс (RT)Dn. (21)
Если парциальные давления компонентов выражены в атмосферах, а концентрации в 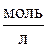 , то в соотношение, (21) связывающее kр и kс, вместо R следует ставить величину R = 0,082
, то в соотношение, (21) связывающее kр и kс, вместо R следует ставить величину R = 0,082  .
.
kр не зависит от давления и концентрации, kс не зависит от концентрации и от давления.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 521; Нарушение авторских прав?; Мы поможем в написании вашей работы!