
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ограниченная взаимная растворимость жидкостей, распределение вещества между двумя жидкими фазами
|
|
|
|
Если компоненты жидкой смеси очень сильно различаются по своей природе (например, вода-бензол, вода-ртуть и др.), то взаимная растворимость их очень мала. Практически такие жидкости не смешиваются друг с другом. Если к смеси двух несмешивающихся (или ограниченно растворимых друг в друге) жидкостей прибавить некоторое количество вещества, растворимого в обеих жидкостях, то оно распределяется между обоими слоями в определенном отношении. Установлено, что при постоянной температуре третий компонент распределяется между обеими жидкими фазами так, что отношение его концентраций в этих двух фазах сохраняется постоянным. Это положение составляет сущность закона распределения, установленного немецким ученым В. Нернстом в 1890г. и подробно исследованного применительно к различным системам советским ученым Н.А. Шиловым.
Если при 25оС в систему, состоящую из хлороформа и воды, ввести йод, то отношение равновесных концентраций йода в хлороформе С1 и воде С2, или так называемый коэффициент распределения составит:
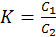 (7.3)
(7.3)
Коэффициент распределения зависит от природы веществ, составляющих систему, и температуры.
Закон Нернста – Шилова в форме (7.3) справедлив в тех случаях, когда добавление третьего компонента не вызывает изменения растворимости жидкостей друг в друге, и если третий компонент в каждой из равновесных жидких фаз находится в одинаковом молекулярном состоянии.
Если же вещество, распределяющееся между обеими жидкими фазами, диссоциирует или ассоциирует, то устанавливается сложное равновесие между простыми и ассоциированными молекулами или ионами в пределах каждой фазы и между фазами. Для этого случая закон распределения можно записать:
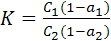 (7.4)
(7.4)
где С1 и С2 – концентрации растворенного вещества АВ в первой и второй фазах;
а1 и а2 – степень диссоциации и ассоциации распределяемого вещества АВ в первой и во второй фазах.
Приводимые выражения справедливы только для разбавленных растворов. Даже для слабых электролитов уже в растворах средней концентрации следует применять активности. При определении распределения сильных электролитов замена активностей концентрациями приводят к неверным результатам.
Опытное значение коэффициентов распределения позволяет определять степень диссоциации или ассоциации растворенного веществ в том или ином растворителе, активности растворенных веществ и т.д.
Знание коэффициента распределения важно и для промышленности при выборе растворителя для процесса экстракции.
Экстрагирование – это извлечение растворенного вещества АВ из раствора соответствующим растворителем, который не смешивается с первым, но в больших количествах растворяет вещество АВ. Обычно этот растворитель подбирают с меньшим удельным весом, чем удельный вес раствора.
Примерами жидкостной экстракции в промышленности могут служить: извлечение йода из водных растворов хлороформом или сероуглеродом; получение концентрированной уксусной кислоты из ее разбавленных растворов путем экстрагирования этилацетатом с последующей перегонкой; отделение пенициллина и других антибиотиков от ферментационных растворов.
Для более полной экстракции вещества необходимо переводить его в то молекулярное состояние, в котором оно находится в обоих растворителях. Например, при извлечении органической кислоты из водных растворов необходимо подавить ее диссоциацию добавлением сильной минеральной кислоты, тогда молекулы органической кислоты экстрагируются более полно и т.д.
При экстракции коэффициентом распределения условились называть отношение концентрации раствора, из которого экстрагируется растворенное вещество, к концентрации раствора, которым производится экстрагирование. Например, коэффициент распределения йода между водой и сероуглеродом равен: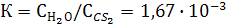
Закон Нернста – Шилова показывает, что экстракцию выгоднее проводить не сразу всем объемом растворителя, а последовательным многократным экстрагированием несколькими порциями растворителя.
Пусть V1 – объем раствора, содержащего определенное количество g0 растворенного вещества, которое надо экстрагировать при помощи второго растворителя, не смешивающегося с первым; V2 – объем растворителя, употребляемый на каждое экстрагирование.
Предположим, что после первого экстрагирования в исходном растворе останется g1 растворенного вещества, тогда количество экстрагированного вещества, заключенного в объеме V2, равно 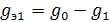 .
.
Если экстрагируемое вещество не диссоциирует и не ассоциирует ни в одном из растворителей, то равновесные концентрации его в первом и втором растворителях будут:
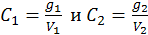 .
.
Согласно закону распределения имеем:
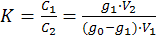 ,
,
откуда
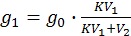 (7.5)
(7.5)
Если после отделения раствора от растворителя снова повторить экстрагирование, добавив тот же объем V2 растворителя, то в него экстрагируется 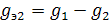 , где g2 – количество вещества, оставшееся после второй экстракции в растворе.
, где g2 – количество вещества, оставшееся после второй экстракции в растворе.
Тогда после второго экстрагирования имеем:
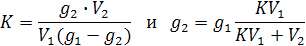
Если вместо g1 подставить его значение из уравнения, получим:
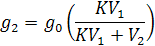
После n – экстрагирований в исходном растворе останется:
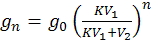 (7.6)
(7.6)
Количество экстрагированного вещества определяется выражением:
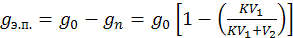 (7.7)
(7.7)
Так как 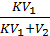 < 1, то из соотношения (7.6) вытекает, что чем больше n, т.е. число экстрагирований, тем меньше количество вещества, остающегося в растворе gn.
< 1, то из соотношения (7.6) вытекает, что чем больше n, т.е. число экстрагирований, тем меньше количество вещества, остающегося в растворе gn.
Таким образом, многократное экстрагирование определенным объемом растворителя выгоднее, чем однократная экстракция этим же объемом растворителя. Например, если извлекать сероуглеродом йод, содержащийся в 1 л воды (0,28 г), то после однократной экстракции 25 мл (0,025 л) сероуглерода в воде остается:
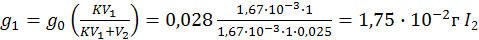 ,
,
что составляет 6,26% исходного количества йода в растворе.
Если тем же объемом СS2 проводить пятикратную экстракцию, т.е.
V2 = 5 мл (0,005 л), то количество йода, остающегося в воде будет:
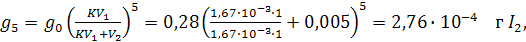 ,
,
что составляет 0,1% исходного количества, т.е. при пятикратной экстракции йод практически полностью извлекается из воды.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1700; Нарушение авторских прав?; Мы поможем в написании вашей работы!