
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон Рауля, применение. Криоскопия и эбулиоскопия
|
|
|
|
Математическое выражение второго закона Рауля имеет вид:
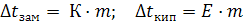 (8.3)
(8.3)
где К – криоскопическая константа, град/моль,
Е − эбулиоскопическая константа, град/моль
m – моляльная концентрация растворенного вещества.
Согласно второму закону Рауля: понижение температуры замерзания и повышение температуры кипения растворов прямо пропорционально моляльной концентрации неэлектролита и не зависит от его природы.
Определяя экспериментально ∆tзам и ∆tкип растворов берут произвольные небольшие навески растворённого вещества В – gB и растворителя А – gA. Тогда моляльная концентрация раствора равна:
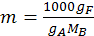 (8.4)
(8.4)
и
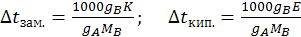 (8.5)
(8.5)
Из приведенных формул (8.5) на основе второго закона Рауля можно определить молярную массу растворенного вещества МB, например:
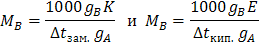
При m = 1, 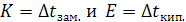 Следовательно, К характеризует моляльное ∆tзам. раствора, Е – моляльное ∆tкип. раствора.
Следовательно, К характеризует моляльное ∆tзам. раствора, Е – моляльное ∆tкип. раствора.
К и Е – величины условные (рассчитаны для моляльного раствора по данным разбавленных растворов). Обе константы характерны для данного растворителя, они не зависят от природы и концентрации растворенного вещества при стандартных условиях, табулированы в справочниках. Могут быть рассчитаны по формулам:
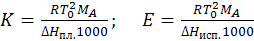 (8.7)
(8.7)
где ∆Нпл. – энтальпия плавления растворителя,
∆Нисп – энтальпия испарения растворителя.
∆tкип зависит от природы растворителя и концентрации растворенного вещества, но не зависит от природы растворенного вещества.
Криоскопия – метод, основанный на измерении ∆tзам. растворов. Служит в биологии и химии для определения суммарной концентрации клеточного сока растений, концентрации почвенных растворов, молярной массы растворенного вещества МB и т. д.
Эбулиоскопия – метод, основанный на измерении ∆tкип. растворов, также используется на практике для вышеуказанных целей.
Первый и второй законы Рауля справедливы для разбавленных растворов неэлектролитов. В случае электролитов число частиц в растворе за счет электролитической диссоциации резко возрастает и в расчетные формулы следует вводить поправки.
Если n – число ионов, образующихся из одной молекулы в растворе электролита, N – число молекул растворенного вещества, то общее число частиц в растворе составляет:
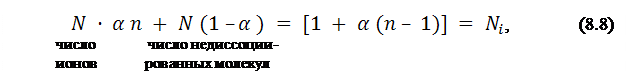
если 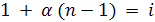 ,
,
где i – изотонический коэффициент, коэффициент Вант – Гоффа.
Таким образом в случае растворов электролитов уравнение второго закона Рауля имеет вид:
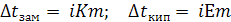 ;
;
(8.9)
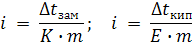
Отсюда 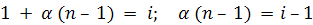 ;
;
(8.10)
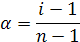
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6315; Нарушение авторских прав?; Мы поможем в написании вашей работы!