
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Peroxoacids. There are the following peroxoacids of sulfur: н2s2o8 is called peroxidisulfuric acid (supersulfuric acid), and н2so5 is peroxomonosulfuric acid (caro acid)
|
|
|
|
Uses
The production of ' superphosphate ' (calcium hydrogen phosphate + calcium sulfate) for fertilisers is the biggest use of sulfuric acid. Second to this is the manufacture of ammonium sulfate from ammonia (by the Haber process). This is also a fertiliser. Other uses are: conversion of viscose to cellulose in the manufacture of artificial silk, and so on; manufacture of explosives, pigments and dyestuffs, as well as many other chemicals, for example hydrochloric acid; refining of petroleum and sulfonation of oils to make detergents; and in accumulators.
Production. Н2S2O8 is obtained electrolytically at the anode in 50% Н2SO4 aqueous solution:
2HSO4- = Н2S2O8 + 2e
Н2S2O8 can form peroxomonosulfuric acid (Caro acid) under the influence of concentrated Н2O2 (Heinrich Caro was a German organic chemist, who obtained this acid in 1898):
Н2S2O8 + Н2O2 = 2Н2SO5
Structure. These acids are regarded as Н2O2 derivatives because groups —O—O— are present in their structure
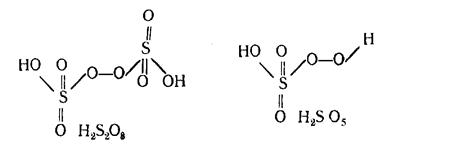
Properties. Н2S2O8 and Н2SO5 are crystalline substances. Their melting points make up 65o and 47o, respectively.
Н2S2O8 is a strong dibasic acid. The O—H bond of the Caro acid dissociates strongly. At the same time, —O—O—H group (like hydrogen peroxide, K = 4∙10-10) dissociates weakly. Therefore, it is a monobasic acid that is stable also in the free state. Salts exist only in solutions.
Peroxoacids and their salts are very strong oxidising agents due to the presence of —O—O— bonds:
2Mn+2SO4 + 5K2S2O8 + 8Н2O = 2KMn+7O4 + 4K2SO4 + 8Н2SO4
When heated with water Н2S2O8 and Н2SO5 hydrolyse:
Н2S2O8 + H2O = Н2SO4 + H2SO5
H2SO5 + H2O = Н2SO4 + H2O2 (industrial method of H2O2 production)
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2069; Нарушение авторских прав?; Мы поможем в написании вашей работы!