
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Thiosulfuric acid and its salts
|
|
|
|
Production in industry: 2Na2S2 + 3O2 = 2Na2S2O3.
In the laboratory: 1. boiling of sulfites aqueous solution with sulfur powder:
Na2SO3 + S = Na2S2O3
|
2. 4SO2 + 2H2S + 6NaOH = 3Na2S2O3 + 5H2O (strong stirring)
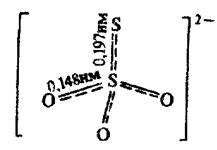
Structure. Thiosulfate, salt of thiosulfuric acid, is a distorted tetrahedron as S—S bond is longer than S—O one. Thiosulfuric acid has two tautomeric forms:

Properties. The strength of thiosulfuric acid is close to H2SO4 (K2 = 2∙10-2), although it is unstable under normal conditions. Therefore, thiosulfates decompose in acidic medium by the reaction:
Na2S2O3 + H2SO4 = Na2SO4 + Na2S2O3 = S¯ + Н2SO3 = SO2 + H2O.
The presence of sulfur (-2) predetermines the reducing properties of thiosulfate. Strong oxidising agents oxidise thiosulfates to elementary S and S (VI) compounds:
Na2SO3S-2 + 4Cl20 + 5H2O = 2H2+6SO4 + 2NaCl-1 + 6HCl.
Na2SO3S-2 + Br20 + H2O = S0¯ + 2NaBr-1 + H2SO4.
"Soft" oxidants (such as I2) form tetrathionates:
2Na2SO3S + I2 = Na2S4O6 + 2NaI.
This reaction is widely used in iodometric methods of analysis in analytical chemistry.
PolythioNIC acids. Na2S4O6 is salt of tetrathionic acid.
Preparation. When gaseous Н2S passes through dilute solution of SО2 Backenroder liquid is obtained. Its composition includes colloidal sulfur and polythionic acids Н2SnO6, where n = 3-20.
Structure. A chain of elemental sulfur atoms between sp3 -hybridized sulfur is a structure feature of polythionic acids. For example, pentathionic acid:
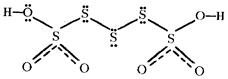 .
.
Properties. Unknown in the free state, polythionic acids are strong acids. Relatively stable are their salts with alkali metals. Acid salts are unidentified.
Important. Н2S2O6 is not polythionic acid, since two pyramidal [SO3]-groups are bound directly through the sulfur atoms. Manganese dithionate can be prepared by passing gaseous SO2 through MnO2 suspension:
2SO2 + MnO2 = MnS2O6
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 424; Нарушение авторских прав?; Мы поможем в написании вашей работы!