
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осадка
|
|
|
|
Произведение растворимости и его взаимосвязь с растворимостью
Равновесия в растворах малорастворимых соединений. Растворимость осадков.
В гравиметрическом анализе неорганических веществ имеют дело, как правило, с осадками, которые представляют собой малорастворимые электролиты. В насыщенном растворе малорастворимого электролита, находящегося в контакте с твердой фазой состава M p A q, протекают одновременно два противоположных процесса, один – растворение осадка за счет перехода ионов с его поверхности в водную фазу. Второй – осаждение ионов из водной фазы на поверхности осадка. По достижении динамического равновесия оба процесса протекают с одинаковой скоростью и равновесное состояние может быть описано выражением:
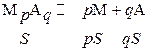 (3.1)
(3.1)
(заряды ионов для упрощения опускаем).
Термодинамическая константа равновесия этой реакции имеет вид:
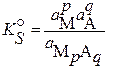
где a M и a A – активности катиона и аниона соответственно.
Поскольку активность твердой фазы в термодинамических расчетах принимается равной 1 ( ), произведение активностей
), произведение активностей  ионов малорастворимого соединения в его насыщенном растворе при постоянной температуре и постоянном давлении также является величиной постоянной и называется термодинамическим произведениемрастворимости (
ионов малорастворимого соединения в его насыщенном растворе при постоянной температуре и постоянном давлении также является величиной постоянной и называется термодинамическим произведениемрастворимости ( или
или 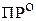 ):
):
 (3.2)
(3.2)
Если известно значение термодинамического произведения растворимости, то легко выяснить, будет ли при данных активностях a M и a A происходить осаждение или растворение осадка. Для этого вычисляют произведение активностей и сравнивают с величиной термодинамического произведения растворимости.
Если: 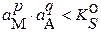 – раствор ненасыщен, твердая фаза растворяется;
– раствор ненасыщен, твердая фаза растворяется;
 – раствор насыщен, имеет место динамическое равновесие;
– раствор насыщен, имеет место динамическое равновесие;
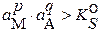 – раствор пересыщен, из него осаждается твердая фаза.
– раствор пересыщен, из него осаждается твердая фаза.
Для сильно разбавленных растворов (с < 1·10–4 моль·л−1) и в отсутствие посторонних электролитов можно считать, что электростатическое взаимодействие между противоположно заряженными ионами в растворе пренебрежимо мало. Тогда активности равны равновесным концентрациям компонентов,
 ;
; 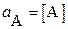
и выражение (3.2) принимает вид:
 (3.3)
(3.3)
Константа равновесия реакции осаждения – растворения, выраженная
через равновесные концентрации, называется концентрационным (условным) произведением растворимости (  .
.
При этом условия растворения или осаждения осадка записываются в виде следующих соотношений.
Если: 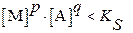 ─ раствор ненасыщен, твердая фаза растворяется;
─ раствор ненасыщен, твердая фаза растворяется;
 ─ раствор насыщен, имеет место динамическое
─ раствор насыщен, имеет место динамическое
равновесие;
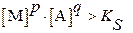 ─ раствор пересыщен, из него осаждается твердая фаза.
─ раствор пересыщен, из него осаждается твердая фаза.
Очень важно помнить, что уравнения (3.2) и (3.3) применимы только к насыщенным растворам, находящимся в равновесии с избытком нерастворенного твердого вещества.
Для условий  ;
; 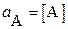 принимают
принимают  . Значения
. Значения 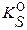 для малорастворимых соединений приводятся в справочной литературе, например,
для малорастворимых соединений приводятся в справочной литературе, например,
[ ] и в приближенных расчетах растворимости осадков, в отсутствие посторонних электролитов и сопряженных равновесий протонирования и комплексообразования, пользуются табличными данными 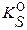 .
.
Зная численное значение произведения растворимости, можно вычислить
молярную величину растворимости (S, моль∙л−1 ) малорастворимого соединения (осадка), то есть молярную концентрацию насыщенного раствора ("растворимость" осадка).
Расчеты проводят, исходя из стехиометрии равновесия (3.1). Из уравнения (3.1) следует, что при растворении S молей формульных единиц соединения  в раствор объемом 1л переходят pS молей катиона и qS молей аниона. В этом случае равновесные концентрации ионов будут равны: [M] = pS и [A] = qS. При подстановке этих выражений в уравнение (3.3) имеем:
в раствор объемом 1л переходят pS молей катиона и qS молей аниона. В этом случае равновесные концентрации ионов будут равны: [M] = pS и [A] = qS. При подстановке этих выражений в уравнение (3.3) имеем:
 (3.4)
(3.4)
После элементарных преобразований получаем общую формулу для расчета растворимости осадка в чистом растворителе (молярной концентрации
насыщенного раствора малорастворимого электролита):
 (3.5)
(3.5)
В случаях, когда p = q = 1 (например, BaSO4, AgCl) формула (2.5) упрощается:
 (3.6)
(3.6)
Из формулы (3.6) следует, что между растворимостью осадка и произведением
растворимости имеется полное соответствие. В этом случае осаждение катиона будет тем более полным, чем меньше произведение растворимости осадка, что
можно проиллюстрировать нижеприведенными примерами.
| Соединение | PbSO4 | AgCl | AgSCN | AgI |
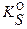
| 1.6·10–8 | 1.8·10–10 | 1.1·10−12 | 8.3·10−17 |
| S = [M] = [A], моль∙л−1 | 1.26·10–4 | 1.34·10–5 | 1.05·10–6 | 9.11·10–9 |
Однако для осадков, имеющих более сложный состав, то есть когда p ≠ q, подобное сопоставление производить нельзя, и необходим расчет по общей формуле (3.5). Действительно, при прямом сопоставлении произведений растворимости для малорастворимых соединений AgCl (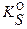 = 1.8·10–10) и Ag2CrO4 (
= 1.8·10–10) и Ag2CrO4 (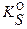 = 1.1·10–12) может создаться ошибочное впечатление, что в насыщенном растворе над хроматом серебра концентрация ионов серебра много меньше. В действительности концентрация ионов серебра в насыщенном растворе над осадком AgCl, согласно формуле (3.6),
= 1.1·10–12) может создаться ошибочное впечатление, что в насыщенном растворе над хроматом серебра концентрация ионов серебра много меньше. В действительности концентрация ионов серебра в насыщенном растворе над осадком AgCl, согласно формуле (3.6), 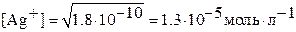 , будет на порядок меньше, чем над осадком Ag2CrO4, для которого, согласно формуле (3.5),
, будет на порядок меньше, чем над осадком Ag2CrO4, для которого, согласно формуле (3.5), 
По значениям S в свою очередь легко рассчитать:
а) массу части осадка, растворяющегося в чистом растворителе,
б) равновесные молярные [ ], массовые  концентрации компонентов и массу компонентов
концентрации компонентов и массу компонентов  и
и  в растворе. (см. таблицу 3.2).
в растворе. (см. таблицу 3.2).
3.2.2. Условие количественного осаждения определяемого иона
Теперь рассмотрим, какие малорастворимые соединения и при каких условиях будут пригодны для их использования в гравиметрическом анализе. В гравиметрическом анализе осаждение считается количественным, когда остающаяся в растворе масса осаждаемого соединения меньше погрешности взвешивания на аналитических весах. Погрешность же взвешивания на обычных аналитических весах составляет 0.1 мг (1·10–4 г). Следовательно, потери, обусловленные растворимостью осадка, должны быть меньше, или, в крайнем случае, равны
1·10–4 г. При осаждении объем всех рабочих растворов, т.е. раствора, из которого ведется осаждение, раствора осадителя и промывных вод от промывания осадка обычно не превышает 0.5 л. Если принять условно молярную массу осадка М (М р А q) = 200 г∙моль−1 [например, M (BaSO4)= 233.4; M (AgCl)= 143.3)], то, согласно требованиям к ОФ и уравнению (3.7):

откуда 
Таким образом, для получения правильных результатов при проведении гравиметрического анализа необходимо создавать условия, при которых растворимость осадка будет равна или меньше 1·10–6 моль∙л−1: (S≤ 1·10–6 моль∙л−1
Таблица 3.2 – Расчетные формулы для расчета растворимости малорастворимого электролита.
| Рассчитываемая величина, ее обозначение | Единицы измерения | Расчетная формула | № формулы |
| Молярная концентрация насыщенного раствора (растворимость) малорастворимого соединения, S | моль∙л−1 | 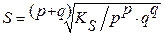
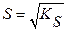
| (3.5) (3.6) |
Масса осадка, растворяющегося в растворителе, 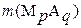
| г | 
| (3.7) |
| Молярная концентрация катиона, [M] аниона, [A] | моль∙л−1 |
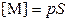

| (3.8a) (3.8б) |
| Массовая концентрация катиона, ρ(М) аниона, ρ (А) | г∙л−1 |
 
| (3.9a) (3.9б) |
| Масса иона в насыщенном растворе катиона, m (М) аниона, m (А) | г |
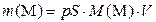

| (3.10а) (3.10б) |
| Объем раствора | л | V |
Рассмотрим, например, осаждение ионов бария в виде BaSO4 из раствора общим объемом 0.5 л при стехиометрических количествах осадителя и осаждаемого иона. Будет ли при этих условиях достигнуто количественное осаждение BaSO4?. Произведение растворимости BaSO4 равно  , а растворимость составляет
, а растворимость составляет  . Тогда, соглас-
. Тогда, соглас-
но уравнению (3.7), масса растворенной (потерянной) части осадка (масса BaSO4 в насыщенном растворе) составит 1.05·10–5·233.4·0.5 ≈ 0.0012 г (1.2 мг), то есть в 12 раз больше предельно допустимого.
При стехиометрических соотношениях реагирующих ионов растворимость осадка малорастворимого соединения часто оказывается намного выше допустимой.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1561; Нарушение авторских прав?; Мы поможем в написании вашей работы!