
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условное произведение растворимости
|
|
|
|
Влияние конкурирующих равновесий протонирования и комплексообразования на растворимость осадков
В реальных условиях на равновесие растворимости могут оказывать существенное влияние конкурирующие процессы протонирования и комплексообразования.
Растворимость осадка, образованного анионом слабой кислоты или катионом, способным образовывать комплексы, может существенно увеличиться в присутствии сильной кислоты или подходящего комплексанта.
Анион слабой кислоты представляет собой основание и в кислых растворах
протонируется по схеме:
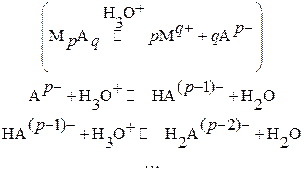
С другой стороны, катион осадка в растворе может координировать вокруг себя подходящие лиганды L – ионы или молекулы. В общем случае имеют место следующие равновесия (заряды для упрощения опущены):
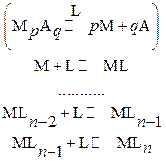
где n – максимальное координационное число.
Как следует из приведенных схем, в итоге протонирования и/или комплексообразования концентрация свободных (не связанных) анионов и катионов в растворе уменьшается. Чтобы обеспечить их концентрацию в растворе, которая будет удовлетворять произведению растворимости, в раствор из осадка должно перейти некоторое количество вещества. Процесс пойдет либо до полного растворения осадка, либо до установления таких концентраций, которые будут удовлетворять произведению растворимости.
Для количественной оценки растворимости осадка в этих случаях используют условное произведение растворимости 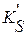 (
(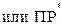 ).
).
Условное произведение растворимости является производным от концентрационного (реального) произведения растворимости, и, в отличие от него, содержит в своем выражении коэффициенты, учитывающие влияние побочных сопряженных равновесий протонирования и комплексообразования.
В качестве таких коэффициентов корреляции выступают мольные доли полностью ионизированных (свободных) катионов и анионов осадка, которые характеризуют глубину протекания конкурирующих реакций. Они представляют собой отношение равновесных концентраций частиц 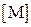 и
и 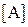 , участвующих в основной реакции, к соответствующим общим концентрациям:
, участвующих в основной реакции, к соответствующим общим концентрациям:
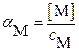 ;
; 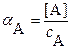
где с M и с A – суммарные (общие) концентрации всех возможных форм этих ионов в растворе:
с M = [M] + [ML1] + … + [ML n ]; с A = [A] + [HA] + [H2A] + ….
Величины мольных долей (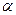 ─ коэффициентов)
─ коэффициентов) 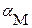 и
и  могут изменяться в пределах от 0 до 1. При отсутствии конкурирующих реакций
могут изменяться в пределах от 0 до 1. При отсутствии конкурирующих реакций 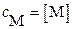 и
и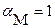 ;
;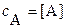 и
и 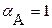 .
.
При наличии конкурирующих реакций 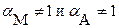 и, следовательно:
и, следовательно: 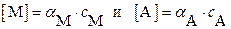
Подставляя эти выражения в уравнение (2.1) для концентрационного произведения растворимости получим: 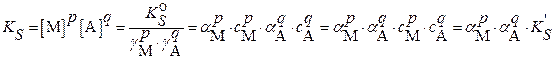 (3.18)
(3.18)
Обычно в приближенных расчетах принимают 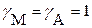 . Тогда
. Тогда 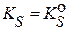 и выражение условной константы растворимости (условного произведения растворимости) приобретает вид:
и выражение условной константы растворимости (условного произведения растворимости) приобретает вид:
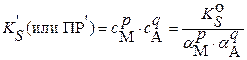 (3.19)
(3.19)
С учетом влияния посторонних электролитов, когда 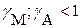
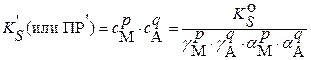 (3.20)
(3.20)
Произведение растворимости, выраженное через произведение суммарной концентрации всех форм существования в растворе катиона малорастворимого соединения на суммарную концентрацию всех форм существования аниона этого соединения называется условным произведением растворимости 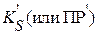 . Концентрации ионов при этом должны быть в степенях, равных стехиометрическим коэффициентам ионов.
. Концентрации ионов при этом должны быть в степенях, равных стехиометрическим коэффициентам ионов.
Для применения в расчетах уравнений (3.4) – (3.5) необходимо уметь вычислять значения 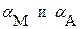 для конкретных условий задачи.
для конкретных условий задачи.
Рассмотрим два крайних случая:
1. Имеет место дополнительная растворимость осадка только за счет побочных реакций кислотно ‑ оснόвного характера. В этом случае можно считать 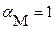 , а для расчета растворимости осадка требуется рассчитать значение
, а для расчета растворимости осадка требуется рассчитать значение 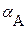 .
.
2. Имеет место дополнительная растворимость осадка только за счет побочных реакций комплексообразования. В этом случае можно считать 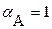 , а для расчета растворимости осадка требуется рассчитать значение
, а для расчета растворимости осадка требуется рассчитать значение 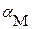 .
.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 3273; Нарушение авторских прав?; Мы поможем в написании вашей работы!