
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость осадков
|
|
|
|
Влияние конкурирующих процессов комплексообразования на
Теперь рассмотрим растворимость осадка при протекании сопряженных реакций комплексообразования, то есть, если αM < 1 и αA = 1.
Если катион осадка в растворе образует с комплексантом L комплексные соединения составов ML i (i = 1… n), то значение мольной доли свободных катионов, не связанных в комплекс, рассчитывают по уравнению:
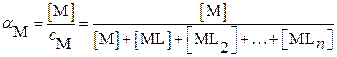 (3.24)
(3.24)
Здесь:
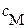 – суммарная равновесная концентрация всех форм катиона, которая слагается из равновесных концентраций всех его не закомплексованных и закомплексованных форм;
– суммарная равновесная концентрация всех форм катиона, которая слагается из равновесных концентраций всех его не закомплексованных и закомплексованных форм;
n – максимальное координационное число иона M в соединениях ML i.
Выразим равновесные концентрации частиц [ML i ] через общие константы
устойчивости (образования) комплексов ML i и равновесную концентрацию
комплексанта [L]:
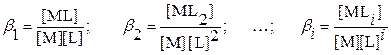
Откуда:
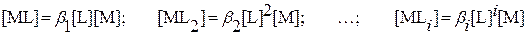
Подставив полученные значения [ML i ] в уравнение (3.24), получим:
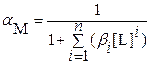 (3.25)
(3.25)
Для практических расчетов удобнее пользоваться не выражением  , а обратной величиной –
, а обратной величиной – 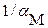 , которую называют функцией закомплексованности и рассчитывают по формуле:
, которую называют функцией закомплексованности и рассчитывают по формуле:
 (3.26)
(3.26)
При рассмотрении влияния комплексообразования на растворимость осадка малорастворимого соединения могут встретиться следующие варианты:
Растворимость осадка при образовании комплексов с посторонними
лигандами.
Пример: Вычислить растворимость AgCl в воде и в 0.01 М растворе NH3
 ; Все значения констант здесь и далее берут из справочных данных, например в [7,8 ].
; Все значения констант здесь и далее берут из справочных данных, например в [7,8 ].
Решение: В насыщенном водном растворе:

В водном растворе  :
: 
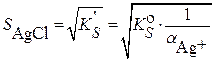 ;
;
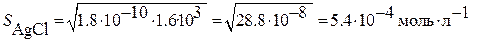
Растворимость возросла в примерно 40 раз.
Растворимость осадка при образовании комплексов с избытком осадителя
Пример: Вычислить растворимость AgCl при
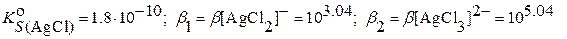
Решение. В насыщенном водном растворе: 
В растворе, содержащем избыток хлорид – ионов при  :
:
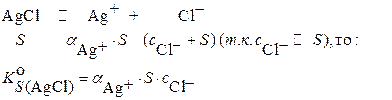
откуда:
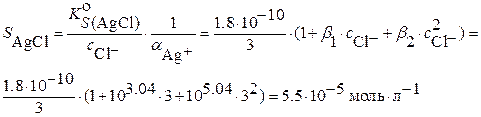
Экспериментально же установлено, что при высоких концентрациях хлорид – ионов растворимость осадка увеличивается во много раз больше расчетного значения, что обусловлено недостаточной информацией о составе комплексов и их константах устойчивости.
Растворимость осадка в буферном растворе, содержащем как посторонний ион – комплексант так и одноименный ион, служащий комплексантом
Пример: Вычислить растворимость хлорида серебра 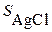 в буферном растворе с
в буферном растворе с  и
и  . Образованием хлоридных комплексов пренебречь.
. Образованием хлоридных комплексов пренебречь.
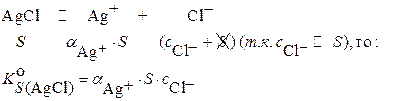
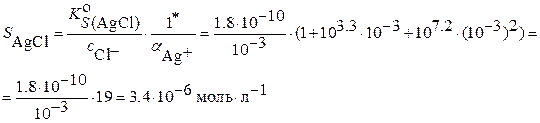
٭Для хлоридных комплексов при 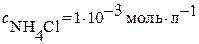
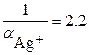 .
.
В заключение следует напомнить соотношения между термодинамическим, концентрационным (реальным) и условным произведениями растворимости и расчетными формулами растворимости:
для идеальной системы: в случае сильно разбавленных растворов
(с < 1·10–4 моль·л−1) и при 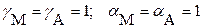


для реальных систем:
а) в присутствии посторонних электролитов:
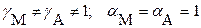
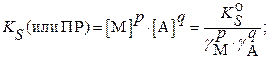

б) при наличии конкурирующих равновесий протонирования и комплексообразования и в отсутствие посторонних электролитов:



в) при наличии конкурирующих равновесий протонирования и комплексообразования и в присутствии посторонних электролитов:
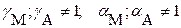

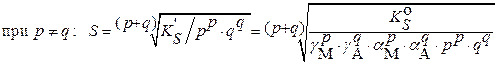
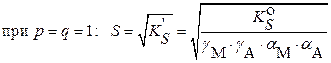
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1521; Нарушение авторских прав?; Мы поможем в написании вашей работы!