
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические основы ЭМА
|
|
|
|
Электрод представляет собой систему, в простейшем случае состоящую из двух фаз, из которых твердая обладает электронной, а другая - жидкая - ионной проводимостью. Твердая фаза с электронной проводимостью считается проводником I рода, а жидкая фаза с ионной проводимостью - II рода.
При соприкосновении этих двух проводников происходит образование двойного электрического слоя (ДЭС). Он может быть результатом обмена ионами между твердой и жидкой фазами, или результатом специфической адсорбции катионов или анионов на поверхности твердой фазы при погружении ее в воду или раствор.
При ионном механизме образования ДЭС, например, в случае, когда химический потенциал атомов на поверхности металла (твердой фазы) больше химического потенциала ионов в растворе, то атомы с поверхности металла будут переходить в раствор в виде катионов: Me «Mez+ + ze-. Освободившиеся электроны при этом заряжают поверхность твердой фазы отрицательно и за счет этого притягивают к поверхности положительно заряженные ионы раствора. В результате на границе раздела фаз образуются два противоположно заряженных слоя, являющихся как бы обкладками своеобразного конденсатора. Для дальнейшего перехода заряженных частиц из одной фазы в другую им необходимо совершить работу, равную разности потенциалов обкладок этого конденсатора. В случае, если химический потенциал атомов на поверхности твердой фазы меньше химического потенциала ионов в растворе, то катионы из раствора переходят на поверхность твердой фазы, заряжая ее положительно: Mez++ «Me. Как в первом, так и во втором случае указанные процессы протекают не бесконечно, а до установления динамического равновесия, которое можно изобразить обратимым редоксипереходом типа Мe -
«Me. Как в первом, так и во втором случае указанные процессы протекают не бесконечно, а до установления динамического равновесия, которое можно изобразить обратимым редоксипереходом типа Мe -  «Мez+ или в общем случае Ох +
«Мez+ или в общем случае Ох +  «Redz+.
«Redz+.
Процессы, при которых отдача или присоединение электронов происходит на электродах, называются электродными.
Нернстом была получена формула, связывающая разность внутренних потенциалов ДЭС с активностями (концентрациями) частиц, участвующих в обратимомредоксипереходе:
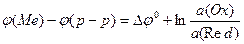 ,
,
где j(Me) - потенциал заряженного слоя твердой фазы; j(р-р) - потенциал прилегающего к твердой фазе слоя раствора; Dj0- константа, равная разности j (Me)- j (р-р), при 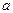 (Ох) =
(Ох) = 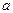 (Red)= 1 моль/л; R - универсальная газовая постоянная (8,31 Дж/К моль); T - температура, К; F - число Фарадея (96 488 Кл/моль); z - число электронов, участвующих в редоксипереходе; a(Ох) и a(Red) - активности окисленной (Ох) и восстановленной (Red) форм вещества в редоксипереходе, моль/л.
(Red)= 1 моль/л; R - универсальная газовая постоянная (8,31 Дж/К моль); T - температура, К; F - число Фарадея (96 488 Кл/моль); z - число электронов, участвующих в редоксипереходе; a(Ох) и a(Red) - активности окисленной (Ох) и восстановленной (Red) форм вещества в редоксипереходе, моль/л.
Установить внутренние потенциалы отдельных фаз j (Me) и j (р-р), к сожалению, экспериментально нельзя. Любая попытка подключить раствор с помощью провода к измерительному устройству, вызывает появление новой поверхности соприкосновения фаз металл-раствор, то есть возникновение нового электрода со своей разностью потенциалов, влияющей на измеряемую величину.
Однако можно измерить разность j (Me) - j (р-р) с помощью гальванического элемента. Гальваническим элементом называется система, составленная из двух разных электродов, обладающая способностью самопроизвольно преобразовывать химическую энергию протекающей в нем окислительно-восстановительной реакции в электрическую энергию. Электроды, из которых составлен гальванический элемент, называются полуэлементами. Протекающая в гальваническом элементе окислительно-восстановительная реакция пространственно разделена. Полуреакция окисления протекает на полуэлементе, называемом анодом (отрицательно заряженном электроде), а полуреакция восстановления - на катоде.
Электродвижущая сила (ЭДС) гальванического элемента алгебраически складывается из разностей внутренних потенциалов составляющих его электродов. Поэтому, если в качестве одного полуэлемента взять электрод с известной величиной разности внутренних потенциалов j (Me) - j (раствор), то по измеренной величине ЭДС можно вычислить искомую разность потенциалов исследуемого электрода.
Для этой цели принято использовать стандартный (нормальный) водородный электрод (см. рис. 2.8.1).Он состоит из платиновой пластинки или проволоки, покрытой платиновой чернью (мелкодисперсной платиной), погруженной в раствор кислоты с 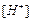 =1моль/л, давление водорода над которым 0,1 МПа (1 атм.). Под каталитическим влиянием платиновой черни в электроде осуществляется обратимый редоксипереход =1моль/л, давление водорода над которым 0,1 МПа (1 атм.). Под каталитическим влиянием платиновой черни в электроде осуществляется обратимый редоксипереход 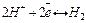 . Разность внутренних потенциалов для водородного электрода в соответствии с формулой Нернста равна: . Разность внутренних потенциалов для водородного электрода в соответствии с формулой Нернста равна:
| 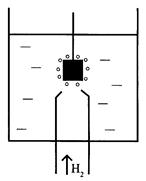 Р и с. 2.8.1. Схема стандартного водородного
электрода
Р и с. 2.8.1. Схема стандартного водородного
электрода
|
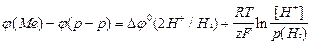 ;
;
так как [ H+ ] = 1моль/л, а р(H2) = 1атм, то
j(Me) - j(р - р) = 
Решением ИЮПАК условно принято считать величину 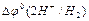 = 0,00 В. Очевидно, что в этом случае измеренная величина ЭДС гальванического элемента, в состав которого входит водородный электрод, равна разности внутренних потенциалов второго электрода. Эту ЭДС принято называть электродным потенциалом или редоксипотенциалом и обозначать буквой Е. Переход от внутренних потенциалов к редоксипотенциалам не меняет характера формулы Нернста:
= 0,00 В. Очевидно, что в этом случае измеренная величина ЭДС гальванического элемента, в состав которого входит водородный электрод, равна разности внутренних потенциалов второго электрода. Эту ЭДС принято называть электродным потенциалом или редоксипотенциалом и обозначать буквой Е. Переход от внутренних потенциалов к редоксипотенциалам не меняет характера формулы Нернста:
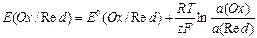 .
.
Для большинства электродов величина электродного потенциала при единичных активностях окисленной и восстановленной форм (Е0) измерена и приведена в справочниках.
При нормальных условиях и переходе от натуральных к десятичным логарифмам предлогарифмический множитель становится равным 0,0591, и формула приобретает вид
 .
.
Следует помнить, что формула Нернста связываетравновесный потенциал с активностями (концентрациями) редоксипары, т. е. потенциал, который приобретает изолированный электрод. Поэтому для аналитических цепей измерение потенциала электрода должно проводиться в условиях, максимально приближенных к равновесным:
1) при отсутствии тока во внешней цепи гальванического элемента;
2) через время, достаточное для достижения равновесия.
Однако в реальных условиях ток может протекать через электроды. Например, ток протекает через электроды в гальваническом элементе, работа которого связана с переходом заряженных частиц через границу раздела «раствор-твердая фаза», а это направленное движение частиц есть ток. Ток протекает через электроды при электролизе, под которым подразумевают совокупность окислительно-восстановительных процессов, протекающих на электродах в растворах и расплавах электродах электролитов под действием внешнего электрического тока. При электролизе можно осуществить процессы, противоположные протекающим в гальваническом элементе.
При протекании тока (i) через электрод потенциал его изменяется и преобретает некую величину Еi, отличную от потенциала электрода в равновесных (изолированных) условиях Ер. Процесс смещения потенциала от Ер до Еi называют поляризацией, а разность h =Ei-Ep - перенапряжением.
Процессам поляризации подвержены не все электроды. Электроды, потенциал которых не изменяется при протекании через них тока, называют неполяризуемыми, а электроды, для которых свойственна поляризация, называют поляризуемыми.
К неполяризуемым относятся, например, электроды II рода, к поляризуемым - все металлические и амальгамные.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 616; Нарушение авторских прав?; Мы поможем в написании вашей работы!