
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрия прямая и косвенная
|
|
|
|
Г л а в а 2.11
(потенциометрическое титрование)
Потенциометрия - это метод анализа, основанный на определении электродного потенциала и нахождении зависимости между его величиной и активностью (концентрацией) потенциалоопределяющего компонента в растворе.
В настоящее время не существует метода измерения абсолютной величины электродного потенциала, однако можно измерить относительную величину, т. е. относительно другого электрода, составляющего с первым гальванический элемент. Измеренная ЭДС гальванического элемента (Е = Е 1 - Е 2) позволяет при известной и постоянной величине электродного потенциала одного из электродов рассчитать потенциал другого.
В качестве электрода сравнения можно использовать стандартный водородный электрод, однако он не особенно удобен в обращении, поэтому, чаще всего в качестве электродов сравнения используют либо хлорсеребряный, либо каломельный электрод.
В качестве индикаторных можно применять электроды I рода. В случае Ag, Hg, Pb, Cd и некоторых других металлов их электродный потенциал хорошо воспроизводим и соответствует формуле Нернста:
 .
.
Однако в других электродах, состоящих из металла и его ионов в растворе, в электродных реакциях участвуют оксиды металла. Такие электроды (Fe, Ni, Co, W, Cr и другие) не являются фактически электродами I рода, имеют не воспроизводимый потенциал и не могут использоваться в качестве индикаторных.
Электроды II рода подходят в качестве индикаторных для анионов AnZ-Например, хлорсеребряный электрод можно использовать в качестве индикаторного на хлорид - ионы:
Е = Е0 - 0,059 lg (Cl-).
(Cl-).
Редоксэлектроды могут использоваться в качестве индикаторных, если их потенциал зависит от отношения окислительной и восстановительной форм определяемого вещества в растворе. Тогда его потенциал может быть использован для контроля изменения этого отношения.
Часто в качестве индикаторных применяют ионоселективные электроды (ИСЭ) с твердыми, жидкими и ферментными мембранами.
В ИСЭ твердая мембрана изготавливается из малорастворимого кристаллического вещества с ионным характером проводимости. Перенос
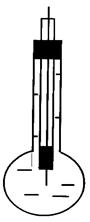 Р и с. 2.11.1. Схема стеклян-ного электрода.
Р и с. 2.11.1. Схема стеклян-ного электрода.
| заряда в таком кристалле происходит за счет дефектов кристаллической решетки. Вакансии могут заниматься ионом только определенного размера и заряда, что обуславливает высокую селективность кристаллических мембран. Наиболее распространенным электродом с твердой мембраной является стеклянный электрод, который широко применяется для определения рН растворов. Он представляет собой тонкостенный стеклянный шарик, заполненный стандартным раствором с определенным значением рН (обычно 0,1М НCl). Внутрь шарика помещают хлорсеребряный электрод (рис. 2.11.1). Перед работой стеклянный электрод некоторое время вымачивают в 0,1М НСl. При этом ионы водорода из раствора обмениваются на ионы натрия из стеклянной мембраны и в системе устанавливается |
равновесие.
Подготовленный таким образом электрод, в котором протоны поверхности стекла находятся в равновесии с протонами раствора, может быть использован для измерения pH.
В процессе измерения на внутренней и внешней границах раздела стекло-раствор происходит реакция обмена ионами водорода, т. е. протекают реакции, не связанные с переходом электронов:
Н+(внутр.Р-р) «H+(стекло) и H+(внеш.Р-р) «H+(стекло)
Потенциал стеклянного электрода, согласно уравнению для мембранного потенциала, будет равен
 .
.
Измерение pH со стеклянным электродом сводится к измерению ЭДС цепи:
Ag,AgCl | 0.1M HCl |стекл. мембр. |анализ. р-р | KCl | AgCl,Ag
a2 (Cl-) aст(H+) aX(H+) a1(Cl-)

| Внутренний хлорсеребряный электрод | Внешний хлорсеребряный электрод |
ЭДС этой цепи равна: Е = Е1 - Е2,
где 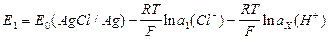 ;
;
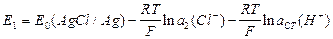 .
.
Подставляя Е1 и Е2 в формулу для ЭДС и объединяя все постоянные величины в Е0стекл, получим
 .
.
В величину Е 0стекл входит и так называемый потенциал асимметрии, представляющий собой разность потенциалов между двумя сторонами стеклянной мембраны. Она возникает из-за несовпадения свойств разных сторон мембраны и может быть измерена экспериментально, если по обе стороны мембраны поместить один и тот же раствор. Величина Е 0стекл зависит также от константы равновесия H+(раствор) «H+(стекло), характеризующая сорт стекла и некоторые другие свойства электрода. Стандартный потенциал Е 0стекл обычно не определяют. При использовании заводских pH-метров эта операция заменяется настройкой прибора по стандартным буферным растворам, так как шкала pH-метров проградуирована непосредственно в единицах pH.
Основными достоинствами стеклянного электрода являются: простота работы, применимость в широкой области pH, малое время отклика и возможность определения pH в окислительно-восстанови-тельных системах, а также в мутных и окрашенных растворах. К недостаткам относится хрупкость конструкции и нарушение электродной функции в сильнокислых и сильнощелочных растворах и большое электросопротивление.
Помимо стеклянного электрода, из электродов с твердой мембраной широко используют фторидный электрод с мембраной из монокристалла LaF3. Практическое значение имеет ИСЭ с мембраной из Ag2S, пригодный для измерения концентрации (активности)Ag+ и S2--ионов. Введение в Ag2S галогенидов серебра или CuS, CdS, PbS делают эти электроды чувствительными к Cu2+, Cd2+, Pb2+, Cl-, Br-, J-, CN--ионами.
В ИСЭ с жидкой мембраной внутренний раствор сравнения отделен от анализируемого тонким слоем органической жидкости, содержащей жидкий ионит XR, не смешивающийся с водой, но селективно реагирующий с определяемым X-ионом. Слой органической ионочувствительной жидкости получается путем пропитки ею пористой гидрофобной мембраны из пластика или целлюлозы. Такой электрод состоит из двух резервуаров (рис. 2.11.2).
Внутренний содержит стандартный раствор определяемого вещества и хлорсеребряный электрод 1,а внешний резервуар – ионочувстви-
 Р и с. 2.11.2. Схема ионоселективного электрода с жидкой мембраной Р и с. 2.11.2. Схема ионоселективного электрода с жидкой мембраной
| тельную жидкость 2, подпитывающую мембрану 3. ИСЭ с жидкой мембраной могут быть обратимыми относительно как катиона, так и аниона. На границе раздела мембрана-раствор в катионселективных электродах устанавливается равновесие KtZ+(м.)«KtZ+(раствор), а в анионселективных - AnZ-(м.)«AnZ- (р - р). Например, кальцийселективный электрод содержит в качестве жидкого ионита кальциевую соль алкилфосфорной кислоты, растворенную в диалкилфенилфосфонате. |
Раствор сравнения внутреннего хлорсеребряного электрода содержит CaCl2. С каждой стороны мембраны устанавливается равновесие Ca2+(м.) «Ca2+(р-р), в соответствии с которым потенциал кальцийселективного электрода равен E=E0мембр-0,059/2 lg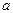 X(Ca2+).
X(Ca2+).
Жидкие мембраны ИСЭ, чувствительные к NO3-, ClO4-, BF4-, содержат соли типа FeL3(NO3)2, NiL3(ClO4)2 и NiL3(BF4)2, где L -фенантролиновый лиганд.
В ферментных электродах, называемых также электрохимическими сенсорами, мембрана, чувствительная к определенному сорту ионов, покрыта тонким слоем фермента. Селективность электрода к ряду веществ определяется высокой специфичностью ферментов, т. е. способностью катализировать превращение одного из сотен и даже тысяч веществ близкой химической природы. Мембрана в ферментных электродах должна быть чувствительной к продуктам каталитической реакции. Например, если фермент катализирует реакцию, в результате которой меняется pH среды, то Н+-чувствительный электрод, покрытый пленкой геля или полимера, содержащего фермент, позволит провести определение только того вещества, которое превращается под действием фермента с образованием Н+-ионов. Разработаны ферментные ИСЭ для быстрого клинического анализа на глюкозу, мочевину, аминокислоты и многие другие жизненно важные вещества.
В гальваническом элементе, составленном для потенциометрических измерений, один из электродов (индикаторный или сравнения) имеет более высокий потенциал. В элементе этот электрод является анодом, а второй - катодом. Если ионопроводящей фазой обоих электродов служит один и тот же раствор, то ЭДС элемента Е = Еан. - Екат.
Чаще приходится составлять гальванические элементы из электродов I рода:
- Zn | Zn2+ ¦ Cu2+ | Cu +. Вертикальной пунктирной линией здесь обозначена поверхность соприкосновения растворов.
Через поверхность соприкосновения растворов ионы одного раствора могут перемещаться (диффундировать) быстрее, чем ионы другого, вследствие чего будет различным и перенос ими зарядов. В результате этого растворы приобретают различные внутренние потенциалы, разность которых называют диффузионным потенциалом. С его учетом
Е = Еан + Едиф - Екат. Поскольку растворы часто содержат несколько разных ионов, величину диффузионного потенциала трудно оценить. Она может составлять от нескольких мВ до нескольких десятых вольта и значительно влиять на результаты потенциометрирования.
Диффузионный потенциал можно существенно уменьшить применением электролитического (солевого) мостика. Он представляет собой стеклянную трубочку, заполненную концентрированным раствором электролита, катион и анион которого диффундируют почти с одинаковой скоростью. Обычно для этих целей используют раствор KCl или NH4NO3 с концентрацией 1...3 моль/л (рис. 2.11.3).
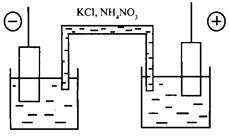 Рис. 2.11.3. Схема гальванического элемента с солевым мостиком.
Рис. 2.11.3. Схема гальванического элемента с солевым мостиком.
| Если некомпенсированный диффузионный потенциал в течение опыта остается постоянным,то его можно объединить с другими константами, например Е ср и Е 0инд. Тогда, обозначив их сумму (Е ср+ Е 0инд + Е диф) как Е 0с.э., получим, что ЭДС гальванического элемента (Е) алгебраически складывается из этой величины |
и члена, показывающего зависимость потенциала индикаторного электрода от активности ионов.
Если индикаторным электродом является электрод I рода или мембранный электрод, то 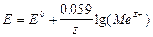 ;
;
если II рода, 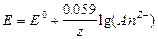 ;
;
если редоксэлектрод, 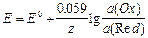 .
.
Знак перед вторым слагаемым зависит от того, является ли индикаторный электрод анодом или катодом. ЭДС, возникшую между индикаторным электродом и электродом сравнения, можно измерить различными способами.
Наиболее распространенным и надежным способом измерения ЭДС гальванических элементов является компенсационный способ Поггендорфа, исключающий протекание тока через электрод в момент измерения его потенциала. На этом методе основан принцип работы различных потенциометров.
Принципиальная схема компенсационного метода показана на рис. 2.11.4. Реохорд 1-2 представляет собой проволоку строго постоянного диаметра. Вследствие этого электрическое сопротивление s единицы его длины тоже величина постоянная. К реохорду подключают аккумулятор А к и гальванический элемент, ЭДС которого Е N известна (стан-
| дартный (нормальный) элемент). Перемещением скользящего контакта на реохорде находят точку, в которой гальванометр не показывает тока. В этом положении сопротивление участка реохорда RN = rlN, и падение напряжения на этом участке IRN = IrlN. Это падение напряжения равно и противоположно по знаку ЭДС стандартного элемента, поэтому они компенсируют друг друга: ЕN = IrlN. После этого с помощью ключа К подключают гальванический элемент Е X, ЭДС которого | 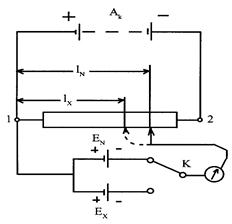 Р и с. 2.11.4. Принципиальная схема компенсационного метода Погген-дорфа.
Р и с. 2.11.4. Принципиальная схема компенсационного метода Погген-дорфа.
|
необходимо измерить, и находят на реохорде точку, в которой гальванометр не показывает тока. Теперь RX = rlX и IRX = IrlX, следовательно, EХ = IrlX. Из соотношения EN/EX = lN/lX, находят искомую ЭДС
EX: EX = EN lX/lN.
В качестве стандартного элемента с известной ЭДС используют элемент Вестона -Сd(Hg) | CdSO4 8/3H2O(нас.), Hg2SO4(т) | Hg+. Здесь анод - амальгама кадмия, а катод - металлическая ртуть. При замыкании цепи протекают полуреакции:
на аноде: Cd(Hg) - 2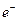 «Cd2+ + Hg(ж);
«Cd2+ + Hg(ж);
на катоде: Hg22+ + 2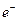 «2Hg (ж).
«2Hg (ж).
При 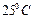 ЭДС элемента Вестона равна 1,0183 В.
ЭДС элемента Вестона равна 1,0183 В.
Компенсационный метод неприменим в тех случаях, когда исследуемый элемент имеет очень высокое сопротивление. Это, например, имеет место в элементе со стеклянным электродом, сопротивление которого 108 Ом. В этом случае ток настолько слаб, что его невозможно зафиксировать гальванометром и провести компенсацию, тогда применяют некомпенсационный метод измерения ЭДС. В последнем методе применяют измерительные приборы, имеющие очень высокое сопротивление. Для этой цели пригодны электронные лампы с сопротивлением между сеткой и катодом порядка 1014 Ом. Если гальванический элемент подключить между сеткой и катодом, то ток в цепи будет практически отсутствовать (1010-10-14 А), и электроды этого элемента будут в равновесных условиях. В то же время анодный ток электронной лампы пропорционален ЭДС гальванического элемента. Усиливая и измеряя анодный ток, можно измерить ЭДС. При этом шкалу измерительного прибора можно проградуировать как в вольтах (единицах ЭДС),так и в единицах рН, рМе и т.п., которые пропорциональны ЭДС. На принципе некомпенсационного метода основана работа таких широко применяемых приборов, как ионометры и рН-метры.
По своему назначению потенциометрию подразделяют на прямую (ионометрию) и косвенную (потенциометрическое титрование).
Прямая потенциометрия основана на прямом применении уравнения Нернста для нахождения активности или концентрации иона в растворе по экспериментально измеренной ЭДС цепи. ЭДС выступает в качестве аналитического сигнала ионометрии. Зачастую по измеренной величине ЭДС вычисляют не активности, а их отрицательные логарифмы (pMe = -lg (MeZ+); pAn = -lg
(MeZ+); pAn = -lg (AnZ-)). На практике величины pMe, pAn находят не расчетом, а по градуировочным графикам, поскольку Е0с.э. содержит некомпенсированную часть Едиф., которую точно вычислить нельзя.
(AnZ-)). На практике величины pMe, pAn находят не расчетом, а по градуировочным графикам, поскольку Е0с.э. содержит некомпенсированную часть Едиф., которую точно вычислить нельзя.
Градуированный график строят по стандартным растворам, значения pMe(pAn) в которых известны и которые используют в качестве ионопроводящей фазы индикаторного электрода. Потом ионопроводящую фазу заменяют на анализируемый раствор и опять замеряют ЭДС. Наконец, по градуировочному графику находят искомое значение pMe(pAn).
Часто по стандартным растворам не строят градуировочный график, а проводят градуировку шкалы измерительного прибора в единицах pMe(pAn). Тогда после замены ионопроводящей фазы индикаторного электрода на исследуемый раствор по шкале прибора непосредственно отсчитывают значение pMe(pAn). Для этих целей используют ионометры. Известны, например, рН - метры, рСа - метры, рF - метры и др.
Ионометрически можно определять не только активность, но и концентрацию ионов. Для этого по оси абсцисс градуировочного графика откладывают отрицательный логарифм не активности, а концентрации. Изображение градуировочной функции тогда имеет отклонения от прямой.
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений ЭДС. В процессе титрования вблизи Т.Э. происходит резкое изменение (скачок) потенциала индикаторного электрода. Для потенциометрического титрования собирают гальванический элемент из индикаторного электрода в анализируемом растворе и электрода сравнения. Метод можно использовать для прото-, редокси-, комплексоно-, седиметрического титрований. Кривые титрования обычно строят в координатах рХ-V (где Х - определяемый ион) (рис. 2.11.5, а).
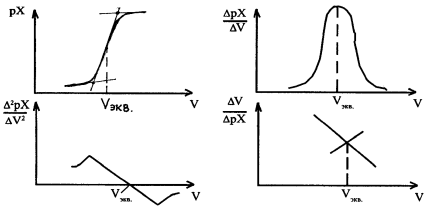
Р и с. 2.11.5. Способы определения эквивалентного объема титранта по гра-
фикам зависимостей: а - рХ = f (V); б - 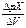 = f (V); в -
= f (V); в - 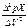 =f (V);г -
=f (V);г -  = f (V)
= f (V)
Точку эквивалентности находят по кривой титрования, как точку, в которой кривая имеет наибольшую крутизну. Более точные результаты получают, используя для нахождения ТЭ графики, построенные в координатах DрХ/DV = f(V) (рис. 2.11.5, б) или D2рХ/DV2 = f(V) (рис. 2.11.5, в). Для этой цели Граном предложено использовать график зависимости DV/DрХ = f(V) (рис.11.5, г). При этом способе вместо кривой получают две прямые, точка пересечения которых соответствует точке перегиба на кривой.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 6469; Нарушение авторских прав?; Мы поможем в написании вашей работы!