
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЭМА без применения электролиза, кондуктометрия прямая
|
|
|
|
Г л а в а 2.10
и косвенная (кондуктометрическое титрование)
Кондуктометрия - это метод, основанный на измерении электропроводности анализируемого раствора.
Электропроводностью W называют величину, обратную электросопротивлению R: W = 1/R, [Ом-1 = См (Сименс)].
Растворы электролитов, являясь проводниками II рода, подчиняются закону Ома: R = U/I. Чтобы измерить сопротивление раствора, в него погружают электроды и подают внешнее напряжение U. По аналогии с проводниками I рода сопротивление раствора прямо пропорционально расстоянию между электродами l и обратно пропорционально площади их поверхности S: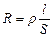 , где r - удельное сопротивление, Ом/см;
, где r - удельное сопротивление, Ом/см;
r = R при l = 1 cм и S = 1см2, т. е. r - сопротивление 1 см3 (мл) раствора.
Величину, обратную r, называют удельной электропроводимостью (c): c = 1/ r, [Cм ×см-1]. Величина c равна электропроводности 1 см3 (мл) раствора, находящегося между электродами с площадью поверхности 1 см2, удаленными друг от друг на расстоянии 1 см.
Из закона Ома следует, что c численно равна току, проходящему через слой электролита с S = 1 см2 под действием градиента потенциала 1В на единицу длины.
Электрическая проводимость разбавленных растворов электролитов зависит от суммарного числа ионов в растворе (то есть концентрации) числа элементарных зарядов, переносимых каждым ионом (то есть заряда иона) и от скорости движения одинаково заряженных ионов к катоду или аноду под действием электрического поля. С учетом этих факторов электропроводящие свойства ионов характеризуются эквивалентной электропроводимостью (l). Ею называют проводимостью раствора, содержащего 1 моль вещества эквивалента и находящегося между двумя параллельными электродами, расстояние между которыми 1 см, [l] = [См см2/моль]. Связь эквивалентной и удельной электропроводностей передается формулой:
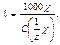
Эквивалентная электропроводность уменьшается с увеличением концентрации за счет увеличения межионных взаимодействий. В бесконечно разбавленных растворах приобретает постоянное и максимальное значение:
l¥ = l¥+ + l¥-,
где l¥+ и l¥- - подвижность катионов и анионов раствора.
Подвижность - это величина, относящаяся к эквиваленту иона (то есть частице с единичным зарядом, например, K+ , ½ Mg2+ , Al3+ и т.п.) и равна произведению абсолютной скорости движения иона на число Фарадея.
Ячейка для измерения электрической проводимости состоит из двух параллельных пластинчатых платиновых электродов, впаянных в стеклянный сосуд, на некотором расстоянии друг от друга.
При измерении электропроводности прохождение тока вызывает химические реакции (электролиз), которые могут производить изменение состава раствора у электрода и вызывать поляризацию электродов. Это может являться источником погрешностей при измерениях. Во избежание этого электропроводность измеряют при переменном токе. Незначительная поляризация постоянно уничтожается при перемене направления тока. Поляризацию уничтожает также платинирование электродов, т. е. покрытие их тонкоизмельченной платиной (платиновой чернью), увеличивающей поверхность электродов.
| Обычной аппаратурой для измерения сопротивления, а следовательно, и электропроводности является мостик Уитстона. Метод для измерения электропроводности с переменным током был впервые применен Кольраушем и носит его имя. Схема прибора Кольрауша приведена на рис. 2.10.1. Сосуд для измерения электро-проводности раствора образует одно плечо мостика с сопротивлением RX, постоянное сопротивле- | 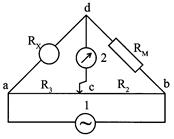 Р и с. 2.10.1. Схема прибора Кольрауша для измерения электропроводности растворов.
Р и с. 2.10.1. Схема прибора Кольрауша для измерения электропроводности растворов.
|
ние R M (магазин сопротивлений) образует другое, калиброванная проволока " аb " с движком " с " образует третье (R 2) и четвертое (R 3) плечи мостика. Положение передвижного контакта "с" подбирается так, чтобы нуль-инструмент 2 не показывал ток (или ток был минимален), тогда сопротивление ячейки RX можно рассчитать по формуле
 .
.
Неизвестную электропроводимость раствора находят так:
 .
.
Промышленностью выпускаются различные приборы для измерения электропроводимости, в том числе и с цифровой индикацией "Ипульс", КЛ-1.
Экспериментально измеряемая величина сопротивления раствора зависит от многих факторов, не всегда поддающихся точному учету (размера электродов, их формы, взаимного расположения и мн. др.). Поэтому истинная электрическая проводимость раствора c связана с экспериментальной c I посредством поправочного коэффициента К, называемого константой сосуда: c = Кc I. К находят экспериментально с помощью стандартных растворов с известными c в широкой области t и с. Обычно в качестве стандартного раствора используют водные растворы KCl.
Различают прямую и косвенную кондуктометрию.
Прямая кондуктометрия (ПК) является неселективным методом анализа - все виды подвижных ионов, находящихся в растворе (или другой исследуемой среде) вносят свой вклад в электропроводность и по измеренным значениям нельзя выявить долю участия отдельных видов. Поэтому ПК используют для определения общей концентрации ионов в растворе, например при непрерывном или периодическом анализе растворов в производственных процессах, степени минерализации природных вод, при контроле процессов промывания осадков и материалов, качества воды после очистки или перегонки. В практической работе обычно используют градуированные графики зависимости электропроводности растворов от концентрации тех или иных электролитов. Малая эффективность является существенным ограничением метода ПК.
Более широко применяется косвенная кондуктометрия - кондуктометрическоетитрование (KT). КТ основано на заметном изменении характера зависимости электропроводности раствора от количества добавляемого титранта вблизи точки эквивалентности вследствие изменения ионного состава раствора. КТ применяют для установления конца кислотно-основного, окислительно-восстановительного, осадительного титрования мутных или окрашенных растворов, когда обычные химические цветопеременные индикаторы использовать нельзя. К достоинству метода относится возможность титрования очень разбавленных растворов (меньше 10-4 моль/л) с погрешностью, не превышающей 2%.
Применение кондуктометрического титрования при реакции нейтрализации основано на значительно большей величине подвижностей ОН- и Н+ - ионов по сравнению с подвижностями ионов металла и кислотного остатка. Например, до начала титрования сильноразбавленного раствора гидролиза натрия его эквивалентная электропроводность равна сумме подвижностей ионов Na+ и ОН-, составляет:
l¥(NaOH) = l¥(Na+)+l¥(OH-) = 50+199=249[См см2/моль].
В момент полной нейтрализации щелочи (ТЭ), например соляной кислотой, в растворе имеются только ионы Na+ и Cl- и эквивалентная электропроводность раствора равна
l¥(NaCl)=50+76.4=126.4 [См см2/моль].
Следовательно, в процессе титрования электропроводность раствора изменяется от 249 до 126,4 См см2/моль. При перетитровании кислотой электропроводность раствора снова начинает расти и равна:
350+76,4+50+76,4 = 553,8 См см2/моль.
Кривая титрования гидроксида натрия соляной кислотой имеет вид (рис. 2.10.2):
| Аналогичные процессы приводят к этому же виду кривые титрования других сильных оснований сильными кислотами или наоборот. При титровании слабых оснований (слабых кислот) сильными кислотами (сильными основаниями), вследствие слабой диссоциации веществ титруемых растворов и связывании в воду Н+ и ОН- ионов, добавляемых с титрантом, электропроводность до точки эквивалентности растет очень слабо. Избыток титранта после ТЭ - | 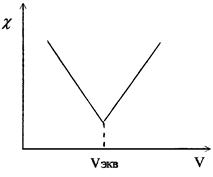 Р и с. 2.10.2. Вид кривой кондуктометрического титрования сильных кислот оснований) сильными осно-
ваниями (кислотами).
Р и с. 2.10.2. Вид кривой кондуктометрического титрования сильных кислот оснований) сильными осно-
ваниями (кислотами).
|
приводит к появлению в титруемом растворе несвязанных Н+(ОН-) ионов и к резкому росту электропроводности (рис.10.3, а). При титровании смеси сильной и слабой кислот (основания) описанные выше процессы приводят к двум изломам на кривой титрования, позволяющим зафиксировать обе ТЭ (рис. 2.10.3, б).
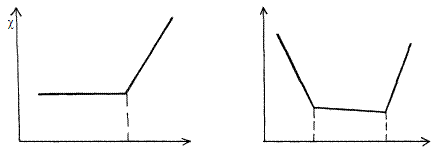
V экв V экв. сил. V экв. сл.
а б
Р и с. 2.10.3. Вид кривых кондуктометрического титрования: а - слабой кислоты (основания) сильным основанием (кислотой); б - смеси слабой и сильной кислот
(оснований) сильным основанием (кислотой).
Различия в подвижностях ионов позволяет проводить их кондуктометрическое определение титрованием.
Высокочастотное кондуктометрическое титрование - одна из разновидностей КТ. Установки для высокочастотного титрования во многом отличаются от установок обычной низкочастотной кондуктометрии.
Ячейка с анализируемым раствором при высокочастотном титровании помещается или между пластинками конденсатора, или внутри индукционной катушки. Соответственно этому в первом случае ячейку называют конденсаторной или емкостной, или С-ячейкой, а во втором - индуктивной или L-ячейкой (рис. 2.10.4).
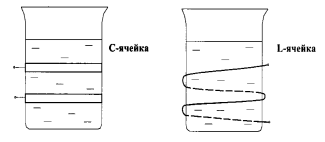
Р и с. 2.10.4. Схемы установок для высокочастотного
кондуктометрического титрования: С- ячейка; L- ячейка.
В ячейках высокочастотного титрования электроды не соприкасаются с исследуемым раствором, что является одним из существенных достоинств метода, позволяющих анализировать высокоагрессивные растворы.
Изменения в ячейке, происходящие в результате реакции титрования, вызывают изменения в режиме работы высокочастотного генератора. Индуктивная L -ячейка с анализируемым раствором включается в цепь колебательного контура (помещается внутрь катушки индукции).
Изменение состава раствора при титровании в такой ячейке вызывает изменение индуктивности, что легко фиксируется микроамперметром через несложную схему. В конденсаторных С -ячейках при титровании раствора вследствие изменения диэлектрической проницаемости происходит сдвиг рабочей частоты генератора, что устанавливается с помощью измерительного конденсатора. При построении кривой титрования показания прибора откладывают как функцию объема добавленного титранта. Промышленностью выпускаются стандартные высокочастотные титраторы.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1235; Нарушение авторских прав?; Мы поможем в написании вашей работы!