
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Г л а в а 2.9
|
|
|
|
Классификация электродов
Ионы, от концентрации которых непосредственно зависит потенциал электрода, называют потенциалоопределяющими для данного электрода.
По природе потенциалоопределяющих ионов различают электроды I рода, II рода, редоксэлектроды и мембранные электроды.
К электродам I рода относятся металлические, амальгамные и газовые. Для них потенциалоопределяющими ионами являются катионы. Они обратимы относительно катионов.
Металлические электроды состоят из металла, погруженного в раствор, содержащий его ионы. Их можно представить в виде схемы: MeZ+/Me, например Ag+/Ag. Им отвечает обратимый редоксипереход: MeZ+ + 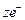 «Me.
«Me.
Их электродный потенциал согласно формуле Нернста, с учетом того, что активность твердой фазы при данной температуре равна единице, можно записать так:
 .
.
Амальгамные электроды состоят из амальгамы металла, находящейся в контакте с раствором, содержащим ионы этого металла: МеZ+/Ме(Hg);
МеZ++ 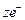 «Ме, например Сd2+/Сd(Hg);
«Ме, например Сd2+/Сd(Hg);
 .
.
Газовыеэлектроды состоят из инертного металла (обычно платины), контактирующего одновременно с газом и раствором, содержащим ионы этого газообразного вещества. Например, водородный электрод.
Электроды I рода обычно используют в ЭМА в качестве индикаторных, т. е. электродов, чей потенциал зависит от концентрации определенных ионов. Эту зависимость называют электродной функцией.
Электроды II рода состоят из металла, покрытого слоем его малорастворимого соединения и погруженного в раствор растворимой соли, содержащей тот же анион, что и малорастворимое соединение. Для них потенциоопределяющими ионами являются анионы. Они обратимы относительно анионов.
AZ-/MA,M;
MA + 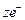 «M + AZ-;
«M + AZ-;
так как 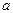 (MA) =
(MA) = 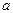 (M) = 1,
(M) = 1,
то 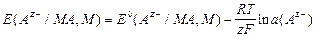 .
.
Электроды II рода широко применяются в электрохимических измерениях в качестве эталонных (электродов сравнения), так как их потенциал устойчив во времени и хорошо воспроизводится, если концентрацию аниона поддерживать постоянной. Наиболее употребительны в качестве электродов сравнения каломельный и хлорсеребряный электроды.
Каломельный электрод состоит из ртути, покрытой пастой, содержащей каломель (Hg2Cl2) и соприкасающейся с раствором KCl, что обзначают схемой Сl-/Hg2Cl2, Hg, а электродную реакцию на нем уравнением ½ Hg2Cl2 +  «Hg + Cl-. В соответствие этому потенциал рассчитывают по формуле:
«Hg + Cl-. В соответствие этому потенциал рассчитывают по формуле:
E(Cl-(Hg2Cl2, Hg)) = 0,2678 - 0,0257 ln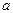 (Cl-), при 298 К.
(Cl-), при 298 К.
Обычно употребляют каломельные электроды с содержанием KCl 0,1М; 1М и насыщенный раствор.
Хлорсеребряный электрод - серебряная пластинка, покрытая AgCl и погруженная в раствор KCl: Cl-/AgCl, Ag
AgCl +  «Ag + Cl-;
«Ag + Cl-;
E(Cl-/AgCl, Ag) = 0,2224 - 0,0257 ln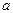 (Cl-) при 298 К.
(Cl-) при 298 К.
При использовании насыщенного раствора потенциал хлорсеребряного электрода при 298 К составляет 0,22 В.
Окислительно-восстановительные (редокс-) электроды состоят из инертного металла (например Pt), погруженного в раствор, содержащий как окисленную (Ох), так и восстановленную (Red) формы вещества: Ох, Red|Pt;
Ох + z «Red;
«Red;
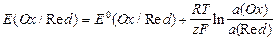 .
.
Различают простые (Sn4+; Sn2+) и сложные (MnО4; Mn2+) редоксисистемы. Соответственно для олова можно записать
Sn4+; Sn2+| Pt; Sn4++ 2 «Sn2+;
«Sn2+;
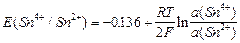 ,
,
а для марганца
MnО4-; Mn2+| Pt; MnО4- + 8H+ + 5 «Mn2+ + 4H2О;
«Mn2+ + 4H2О;
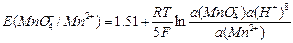 .
.
В мембранных (ионоселективных) электродах, важнейшей составной частью является полупроницаемая мембрана. Это тонкая жидкая или твердая пленка с преимущественной проницаемостью только для ионов одного сорта (например Na в присутствии ионов других щелочных металлов). Механизм полупроницаемости мембран может быть различен. В одних случаях мембрана имеет поры определенной величины, через которые ионы больших размеров не переходят, в других случаях она сделана из материала, который растворяет одно из присутствующих в растворе веществ и таким образом обеспечивает прохождение его через мембрану. Часто материалом мембраны служит органический или неорганический ионит, матрица которого содержит ионогенные группы. Последние могут обменивать входящие в их состав ионы на другие ионы и таким образом обеспечивать прохождение последних через мембрану.
в присутствии ионов других щелочных металлов). Механизм полупроницаемости мембран может быть различен. В одних случаях мембрана имеет поры определенной величины, через которые ионы больших размеров не переходят, в других случаях она сделана из материала, который растворяет одно из присутствующих в растворе веществ и таким образом обеспечивает прохождение его через мембрану. Часто материалом мембраны служит органический или неорганический ионит, матрица которого содержит ионогенные группы. Последние могут обменивать входящие в их состав ионы на другие ионы и таким образом обеспечивать прохождение последних через мембрану.
Пусть, например, ионообменная мембрана разделяет внутренний стандартный раствор №2 иона А+ с концентрацией С2 и внешний анализируемый раствор №1 этого же иона с концентрацией C1. В результате ионного обмена иона А+ из внутреннего и внешнего растворов будут протекать в фазу мембраны. Разность концентраций ионов А+ в растворе и фазе мембраны приведет к возникновению на обеих поверхностях мембраны граничных потенциалов Е 1 и Е 2. Если во внешний и внутренний растворы поместить одинаковые электроды сравнения, то можно измерить разность потенциалов Е 1- Е 2, равную потенциалу мембраны Е М:
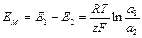 .
.
Так как активность ионов А+ во внутреннем стандартном растворе постоянна, то
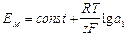 .
.
Основная проблема, возникающая при использовании мембранных электродов в качестве индикаторных, их избирательность (селективность). В идеальном случае электродная функция должна выражать зависимость только от определяемого вида ионов АZ+. Однако подобрать мембрану, через которую проходили только эти ионы, практически невозможно. Как правило, через мембрану проходят и другие ионы, влияющие на ее потенциал. Селективность мембранного электрода принято оценивать коэффициентом селективности К А,В, учитывающего вклад посторонних ионов 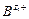 в величину электродного потенциала. Чем меньше К, тем меньше влияние посторонних ионов на мембранный потенциал, тем больше селективность мембранного электрода. С учетом коэффициента селективности величину мембранного потенциала рассчитывают по формуле Никольского:
в величину электродного потенциала. Чем меньше К, тем меньше влияние посторонних ионов на мембранный потенциал, тем больше селективность мембранного электрода. С учетом коэффициента селективности величину мембранного потенциала рассчитывают по формуле Никольского:
 .
.
В качестве индикаторных используют только мембранные электроды с К <1, такие электроды называют ионоселективными.
 ,
,
где КА-В - константа равновесия реакции обмена, в результате которой посторонние ионы 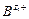 проникают в фазу мембраны:
проникают в фазу мембраны:
AМZ+ +  «
« + Aр-рZ+;
+ Aр-рZ+;
l (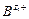 ) и l(AZ+) - подвижности
) и l(AZ+) - подвижности 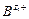 и AZ+ ионов в фазе мембраны.
и AZ+ ионов в фазе мембраны.
Основными характеристиками ионоселективного электрода являются: интервал выполнения электродной функции, селективность и время отклика.
Интервал выполнения электродной функции относительно определяемого иона А+характеризуется протяженностью линейного участка зависимости потенциала электрода от логарифма концентрации (активности) иона А.
Если зависимость имеет угловой коэффициент при 25°С, близкий к 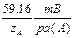 , то электрод выполняет нернстовскую функцию в данном интервале. Для лучших электродов нарушение нернстовской функции наблюдается только при С А < 10-7моль/л. Точка перегиба на графике Е= f(
, то электрод выполняет нернстовскую функцию в данном интервале. Для лучших электродов нарушение нернстовской функции наблюдается только при С А < 10-7моль/л. Точка перегиба на графике Е= f( (A)) характеризует предел обнаружения А+ с помощью данного электрода (рис. 2.9.1).
(A)) характеризует предел обнаружения А+ с помощью данного электрода (рис. 2.9.1).
| Селективность электрода относительно определяемого иона А в присутствии постороннего иона В характеризуется величиной К А,В. Если К А,В<1, то электрод селективен относительно иона А, а если К А,В >1, то | 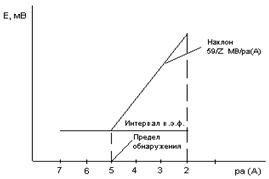 Р и с. 2.9.1. Определение интервала выполнения элект-
родной функции по графику зависимости Е = f(ра(A)).
Р и с. 2.9.1. Определение интервала выполнения элект-
родной функции по графику зависимости Е = f(ра(A)).
|
| относительно иона В. Для определения К А,В измеряют Е М в растворах с постоянным содержанием В и уменьшаемым А. При каком-то минимальном значении ра (А) линейный характер зависимости Е=f(ра (A)) нарушается (рис. 2.9.2). Это означает, что потенциал электрода перестает зависеть от а (А), т. е. |  Рис.2.9.2. Определение селективности электрода относительно вещества А по зависимости Е = f(ра (A)).
Рис.2.9.2. Определение селективности электрода относительно вещества А по зависимости Е = f(ра (A)).
|
теряет электродную функцию от А и не отличает ио- нов А от В. В точке пересечения линейных участ ков Е А= Е В и при
ZA = ZB: а(A)/а(B) = KA,B. Чем меньше К А,В, тем выше селективность электрода относительно иона А.
Время отклика ионоселективного электрода характеризует время достижения постоянного потенциала электрода. Чем меньше время отклика, тем лучше электрод. Оно может колебаться от секунд до минут. Это зависит от природы мембраны и методики проведения измерений (переносят ли электрод из разбавленного раствора в концентрированный или наоборот). Для большинства электродов потенциал в течение 1 мин. достигает 90% конечного значения.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1402; Нарушение авторских прав?; Мы поможем в написании вашей работы!