
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие понятия катализа
|
|
|
|
Катализ – явление изменения скорости химических реакций под воздействием веществ, называемых катализаторами (Kat). Катализатором называют вещество, изменяющее скорость химических реакций, но в результате реакции остающееся без изменения. Если Kat ускоряет химическую реакцию, катализ называется положительным, если замедляет – отрицательным. Отрицательный катализ применяют для подавления нежелательных побочных реакций. Катализаторы в отрицательном катализе –это ингибиторы (ингибиторы коррозии металлов, ингибиторы окисления, полимеризации и т.д.). Различают гомогенный, гетерогенный и биокатализ (ферментативный) катализ.
При гомогенномкатализе реагирующие вещества составляют с катализатором одну фазу, например, разложение муравьиной кислоты в присутствии ионов водорода (Н+).
В ряде промышленных химических процессов катализатором является поверхность твердого тела, а исходные реагенты в газообразной или жидкой фазе соприкасаются с ней. Этот вид катализа называют гетерогенным. Так, при соприкосновении смеси олефинов (RCH=CH2) и водорода с платиной (Pt), нанесенной на силикагель SiO2 (или алюмогель Al2O3) идет быстрый процесс гидрирования:
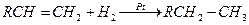
Микрогетерогенный катализ имеет место, когда Kat находится в раздробленном (высокодисперсном) состоянии.
В гетерогенных процессах суммарная скорость определяется скоростью одной из трех стадий реакции:
· подвод вещества к поверхности твердой фазы;
· элементарный акт реакции;
· отвод продуктов реакции.
Биокатализ – ускорение биохимических реакций при участии белковых макромолекул, называемых ферментами. Он составляет основу многих современных технологий получения глюкозы, антибиотиков, витаминов и др.
Как правило, катализаторы обладают специфичностью, т.е. способностью изменять скорость и (или) направление только конкретной химической реакции или группы однофазных реакций. Катализаторы, не обладающие специфичностью, называют универсальными. К ним, в частности, относятся металлы Ni, Pd, Pt, которые катализируют химические процессы окисления, гидрирования и т.п.
Химические процессы являются автокаталитическими, если катализатором служит один из продуктов реакции, поэтому такие процессы ускоряются со временем. Катализатор в равной степени ускоряет прямую и обратную реакции, не влияя на положение равновесия. Наличие в зоне реакции посторонних веществ по-разному отражается на действии катализатора: одни вещества усиливают действие Kat, их называют промоторами или активаторами, например, добавка сульфатов щелочных металлов в сотни раз повышает активность V2O5 – катализатора окисления SO2 в SO3. Вещества, подавляющие каталитическую активность Kat, называют каталитическими ядами. Примером таких веществ является кислород и его соединения, вызывающие «отравление» железного катализатора.
В настоящее время не существует единой теории катализа. Для описания гомогенного катализа разработана теория промежуточных соединений. Механизм действия Kat согласно этой теории рассмотрим на примере А + В = АВ, медленно протекающую в отсутствии Kat. В присутствии Kat эта реакция проходит в две быстро протекающие стадии: А + Кat = АКat и АКat + В = АВ + Кat. Причиной ускорения катализируемых химических реакций является низкая энергия активации Kat. Катализатор направляет ход реакции через такие промежуточные соединения, образование которых не требует большой затраты энергии на активацию реагентов.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 510; Нарушение авторских прав?; Мы поможем в написании вашей работы!