
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Гидролиз (гидролитическое расщепление или гидролитическая деструкция) – обменная реакция между веществом и водой
|
|
|
|
Гидролиз (гидролитическое расщепление или гидролитическая деструкция) – обменная реакция между веществом и водой.
Аналогичные реакции для неводных сред называют сольволизом. Гидролиз – разновидность ионных реакций сольволиза. Реакция нейтрализации между различными по силе кислотами и основаниями не всегда доходит до конца вследствие протекания обратного процесса – гидролиза образующейся соли, т.е. процесса, обратного реакциям нейтрализации.
Ранее было показано, что большинство солей в водных растворах диссоциирует на катион металла и кислотный остаток. Например,
CH3COONa ® Na+ + CH3COO-.
Определенная доля молекул воды (хотя и очень малая) диссоциирует на ионы Н+ и ОН-:
Н2О «Н+ + ОН-.
Ионы, образовавшиеся в результате диссоциации солей, могут взаимодействовать с ионами воды с образованием малодиссоциированных соединений (слабых электролитов). В данном случае
СН3СОО- + Н+ ® СН3СООН,
и реакция гидролиза записывается в виде
NaCH3COO + H2O «CH3COOH + NaOH
или в ионной форме
СН3СОО- + Н2О «CH3COOH + ОН-.
Таким образом, сущность гидролиза состоит в том, что катионы соли (слабое основание), или ее анионы (слабая кислота), либо оба вида ионов одновременно могут связывать соответственно ионы ОН- или Н+ воды, либо и те и другие с образованием слабого электролита – соответственно, основания, кислоты или основания и кислоты сразу). Различают гидролиз трех типов 1) гидролиз солей, образованных слабым основанием и сильной кислотой (рН растворов таких соединений меньше 7); 2) гидролиз солей, образованных сильным основанием и слабой кислотой (рН> 7); 3) гидролиз солей, образованных слабым основанием и слабой кислотой (рН@ 7).
Рассмотрим подробнее процесс гидролиза солей для всех случаев.
Соли слабого основания и сильной кислоты (гидролиз по катиону), например, Al2(SO4)3, FeCl2, NH4Cl. Среда при этом виде гидролиза кислая (рН <7),
FeCl2 ® Fe2+ + 2Cl-,
Cl- + HOH ® реакция не идет,
Fe2+ + H2O «Fe(OH)+ + H+ (1 ступень),
Fe(OH)+ + HOH «Fe(OH)2 + H+ (2 ступень).
Соответствующие молекулярные уравнения 1 и 2 ступени гидролиза
FeCl2 + H2O «Fe(OH)Cl + HCl,
Fe(OH)Cl + H2O «Fe(OH)2 + HCl.
Соли сильного основания и слабой кислоты (гидролиз по аниону). При гидролизе KClO, Na2CO3, CH3COONa, Na2S, K2SiO3 создается щелочная среда (рН > 7), например,
CH3COONa + H2O «CH3COOH + NaOH (рН > 7).
При растворении солей многоосновных кислот гидролиз протекает ступенчато, например
Na2S ® 2Na+ + S2-
Na+ + HOH ® реакция не идет
S2- + HOH «HS- + OH- (1 ступень)
HS- + HOH «H2S + OH- (2 ступень)
Молекулярные уравнения соответственно имеют вид:
Na2S + H2O «NaHS + NaOH,
NaHS + H2O «H2S + NaOH.
Соли слабого основания и слабой кислоты (гидролиз по катиону и аниону) – Al2S3, CH3COONH4, (NH4)2CO3). Например,
CH3COONH4 ® CH3COO- + NH4+,
CH3COO- + HOH «CH3COOH + HO-,
NH4+ + HOH «NH3·H2О + H+.
Итоговое уравнение в ионном виде
CH3COO- + NH4+ + HOH «CH3COOH + NH3·H2О,
молекулярное уравнение
CH3COONH4 + H2O «CH3COOH + NH3·H2О.
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований. Для вышеприведенной реакции гидролиза CH3COONH4 раствор будет слабощелочной (т.е. pH>7).
Если соль образована катионами сильного основания и анионом сильной кислоты (NaCl, K2SO4) гидролиза не происходит, так как в этой водной системе имеется лишь один слабый электролит – Н2О, и поэтому отсутствует возможность связывания ионов Н+ и ОН-.
На глубину гидролиза влияют те же факторы, что и на ионные равновесия вообще: температура, концентрация соли и т.д. Количественной характеристикой гидролиза служат константы равновесия и степень гидролиза.
Степень гидролиза (h), равна отношению числа гидролизованных молекул к общему числу растворенных молекул, которое определяется концентрацией вещества. Степень гидролиза соли зависит от константы гидролиза и концентрации соли и выражается в процентах или долях единицы. Она связана с константой гидролиза следующим соотношением:
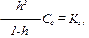
где Сс – концентрация соли, Кг – константа гидролиза, h – степень гидролиза. Это уравнение справедливо для солей, образованных как сильной кислотой и слабым основанием, так и слабой кислотой и сильным основанием.
Гидролиз солей играет большую роль в жизнедеятельности организмов. При гидролизе минералов происходят изменения в составе земной коры. Гидролиз широко применяется в химической промышленности получения сахаров, спиртов, пищевых органических кислот, мыла, глицерина и других веществ. Реакции, происходящие при гидролизе, используются при получении коллоидных растворов, для очистки воды, подаваемой в парогенераторы, и для других целей.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1648; Нарушение авторских прав?; Мы поможем в написании вашей работы!