
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродные потенциалы
|
|
|
|
ЛЕКЦИЯ 5
Электрохимия – раздел физической химии, в котором изучают объемные и поверхностные свойства конденсированных тел, содержащих подвижные ионы, а также механизмы процессов с участием ионов на границе раздела и в объеме тел.
Электрохимические процессы – это химические процессы, сопровождающиеся появлением электрического тока или вызываемые подведенной извне электрической энергией. В их основе лежат окислительно-восстановительные реакции. В электрохимических реакциях (в отличие от обычных окислительно-восстановительных) процессы окисления и восстановления являются пространственно разобщенными. Каждый из этих процессов протекает на поверхности своего электрода, поэтому их называют электродными процессами.
Электрод – часть проводника (обыкновенно в виде пластинки), через которую электрический ток вводится в жидкость или газ. Положительный электрод – анод, отрицательный электрод – катод.
Из электродов и электролита может быть составлена система, в которой химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию. Такую систему называют гальваническим элементом ( названного в честь Луиджи Гальвани). Сила, обусловливающая перемещение в ней электрических зарядов, называется электродвижущей силой (ЭДС). Электродвижущие силы принято представлять в виде разности двух потенциалов, каждый из которых отвечает полуреакции, протекающей на одном из электродов:
Е = j1 – j2.
Потенциалы на электродах j1 и j2 называют электродными потенциалами.
Электродные потенциалы возникают вследствие взаимодействия металла с электролитом. При погружении металлического электрода в водный раствор его соли между поверхностью электрода и раствором будет происходить процесс обмена. Кристаллическая решетка металла состоит из положительно заряженных ионов (катионы) и свободных валентных электронов. При погружении металла в водный раствор его соли полярные молекулы воды, взаимодействуя с катионами металлической решетки (гидратация), облегчают переход катионов металла в раствор. Благодаря гидратации переход ионов в раствор (процесс ионизации) становится энергетически выгодным:
Me + Н2О ® Men+ Н2О + ne,
где Мe – металл, (Men+ × Н2О) – гидратированный катион металла;
n – валентность металла;
е – электрон.
Этот процесс нарушает первоначальную электронейтральность металла и раствора: металл заряжается отрицательно, а слой электролита около него – положительно.
Одновременно в растворе всегда возможен обратный процесс – осаждение металла:
Men+ × Н2О + ne ® Me + Н2О.
Когда скорости ионизации и осаждения сравняются, процесс обмена между металлом и электролитом достигнет состояния равновесия:
Me + aq ® Men+ × aq + ne.
Процесс обмена приводит к образованию на границе металл-электролит двойного электрическогослоя (рисунок 5.1), т. е. к разделению электрических зарядов.
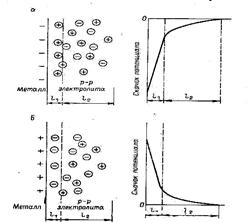
Рисунок 5.1 - Схема двойного электрического слоя и распределение потенциала по его толщине. Металл заряжается отрицательно (а) и положительно (б) в процессе возникновения электродного потенциала. i 1 и i 2 – плотная и диффузная части двойного электрического слоя
Отрицательные и положительные заряды на границе металл – раствор электролита обусловливают возникновение в пограничной области скачка потенциалов, представляющего собой электродный потенциал. Потенциал электрода – физическая величина, зависящая от природы металла и электролита, которая характеризует окислительно-восстановительный процесс. Электродный потенциал измеряют, сравнивая с другим электродным потенциалом, величину которого условно принимают за нуль. Роль электрода, потенциал которого считается равным нулю, выполняет так называемый стандартный водородный электрод.
Электродный потенциал, измеренный в стандартных условиях (Т = 293 К, р = 101,3 кПа (760 мм рт. ст.), С = 1 моль/л) в сравнении с водородным электродом, называют стандартным электродным потенциалом и обозначают Е 0. По величине Е0 все металлы можно расположить в ряд, называемый рядом напряжений металлов или электрохимическим рядом напряжения металлов (таблица 5.1).
Электрохимический ряд напряжений характеризует свойства металлов в водных растворах:
1) чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается;
2) металлы, имеющие отрицательные электродные потенциалы, т. е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот;
3) каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
Таблица 5.1 – Ряд напряжения металлов
| Металл | E o, В | Металл | E o, В | |
| Li+ / Li | – 3,045 | Ga3+ / Ga | – 0,560 | |
| Rb+ / Rb | – 2,925 | Fe2+ / Fe | – 0,441 | |
| K+ / K | – 2,924 | Cd2+ / Cd | – 0,404 | |
| Cs+ / Cs | – 2,923 | In3+ / In | – 0,338 | |
| Ra2+ / Ra | – 2,916 | Co2+ / Co | – 0,277 | |
| Ba2+ / Ba | – 2,905 | Ni2+ / Ni | – 0,234 | |
| Sr2+ / Sr | – 2,888 | Sn2+ / Sn | – 0,141 | |
| Ca2+ / Ca | – 2,864 | Pb2+ / Pb | – 0,126 | |
| Na+ / Na | – 2,771 | H+ / H2 | ± 0,000 | |
| Ac3+ / Ac | – 2,600 | SbIII / Sb | + 0,240 | |
| La3+ / La | – 2,522 | ReIII / Re | + 0,300 | |
| Y3+ / Y | – 2,372 | BiIII / Bi | + 0,317 | |
| Mg2+ / Mg | – 2,370 | Cu2+ / Cu | + 0,338 | |
| Sc3+ / Sc | – 2,077 | Hg22+ / Hg | + 0,796 | |
| Be2+ / Be | – 1,847 | Ag+ / Ag | + 0,799 | |
| Al3+ / Al | – 1,700 | Rh3+ / Rh | + 0,800 | |
| Ti3+ / Ti | – 1,208 | Pd2+ / Pd | + 0,915 | |
| Mn2+ / Mn | – 1,192 | PtII / Pt | + 0,963 | |
| Cr2+ / Cr | – 0,852 | Au+ / Au | + 1,691 | |
| Zn2+ / Zn | –0,763 | – | – |
Электродный потенциал окислительно-восстановительной системы, находящейся в нестандартных условиях можно рассчитать по уравнению Нернста (предложено в 1906 г. немецким физиком и химиком, Нобелевским лауреатом В. Нернстом):
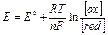 ,
,
где Е – равновесный потенциал окислительно-восстановительного электрода, B;
E0 – стандартный потенциал этого электрода, B;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль×град);
Т – температура, K;
n – число электронов в уравнении электродной реакции;
F – число Фарадея, равное 96485 Кл/моль; [ ox ] и [ red ] – концентрации окисленной и восстановленной форм участников в электродной реакции.
Другая форма уравнения Нернста:
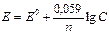 ,
,
где n – валентность катиона;
С – концентрация электролита (С = [ ox ] / [ red ]).
 Для водородного электрода уравнение Нернста имеет вид:
Для водородного электрода уравнение Нернста имеет вид:
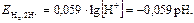
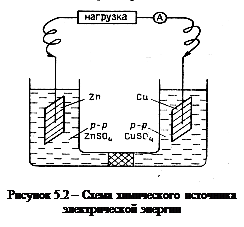
Гальванический элемент состоит из двух полуэлементов (окислительно-восстановительных систем), соединенных между собой металлическим проводником. На рисунке 5.2 показан элемент, состоящий из двух металлических электродов (Zn и Cu), опущенных в растворы их солей (ZnSO4 и CuSO4). На каждом полуэлементе (в данном случае Zn/ZnSO4 и Cu/CuSO4) происходит полуреакция (электродный процесс). Ток во внешней цепи будет протекать до тех пор, пока на электродах будут идти процессы обмена, обусловливающие установление на электродах свойственных им электродных потенциалов.
При разомкнутой цепи (так называемый режим «холостого хода») на электродах в результате процессов обмена устанавливаются равновесия, которым в стандартных условиях соответствуют стандартные потенциалы:
Zn ® Zn2+ + 2e, E0Zn/Zn2+ = -0,76 B;
Cu ® Cu2+ + 2e, E0Cu/Cu2+ = + 0,34 B.
При замыкании электрической цепи электроны от электрода с меньшим потенциалом (т. е. цинкового) будут переходить к электроду с большим потенциалом (медному). На электродах будут проходить следующие изменения. Уход электронов от цинкового электрода приводит к нарушению равновесия, и его электродный потенциал должен был бы измениться. Однако пока существует электрохимическая система Zn/Zn2+, будут сохраняться и все свойства, присущие ей, в том числе и соответствующий электродный потенциал. Несмотря на ушедшие к медному электроду электроны, потенциал цинкового электрода будет поддерживаться за счет протекания процесса Zn ® Zn2+ + 2е(окисление), т. е. за счет разрушения цинка и перехода ионов Zn2+ в раствор. Таким образом, уход электронов во внешнюю цепь компенсируется появлением новых электронов за счет окисления цинка. Электрод, на котором протекает процесс окисления, называется анодом.
Электроны, перешедшие по внешней цепи на медь, также должны нарушить первоначальное состояние равновесия. Однако пока существует электрод Cu/Cu2 +, на нем будет поддерживаться и соответствующий потенциал. Это возможно только в том случае, если поступившие к меди электроны израсходуются в ходе процесса, потребляющего электроны. Таким процессом является процесс восстановления ионов меди: Cu2+ + 2е ® Cu. Электрод, на котором протекает реакция восстановления, называют катодом.
Суммируя анодную (окисление) и катодную (восстановление) реакции, получим уравнение окислительно-восстановительного процесса:
Zn + Cu2+ ® Cu + Zn2+.
Самопроизвольное протекание этого процесса обусловливает работу гальванического элемента. В любой окислительно-восстановительной реакции процессы окисления и восстановления протекают одновременно и взаимосвязано. В гальваническом элементе эти процессы пространственно разделены, но взаимозависимы: электроны процесса окисления анода участвуют в процессе восстановления на катоде.
Таким образом, в любом химическом источнике электрической энергии электрический ток – это результат самопроизвольного протекания окислительно-восстановительных реакций на электродах. Для расчета ЭДС гальванического элемента следует из потенциала медного электрода вычесть потенциал цинкового электрода, т. е.
D Е0 = Е0К – Е0А = Е0 Cu/Cu2+ – E0 Zn/Zn2+= 0,34 – (– 0,76) = 1,1 В.
Итак, любому самопроизвольно протекающему окислительно-восстановительному процессу отвечает положительная ЭДС.
Окислительно-восстановительные цепи в водных растворах могут образовываться самопроизвольно при простом смешении веществ в растворах. С помощью электрохимического ряда напряжений можно установить, какие вещества в системе будут окисляться, а какие восстанавливаться. Стандартные окислительно-восстановительные потенциалы позволяют определить возможность сосуществования тех или других веществ в данной среде. Например, в воде в присутствии растворенного кислорода могут находиться сероводород, сульфиты и другие вещества с меньшими окислительно-восстановительными потенциалами.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 5520; Нарушение авторских прав?; Мы поможем в написании вашей работы!