
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Предельные альдегиды и кетоны
|
|
|
|
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегидами и кетонами называют производные углеводородов, содержащие карбонильную группу С=О. В молекуле альдегидов по крайней мере одна валентность карбонильной группы затрачивается на соединение с атомом водорода, а другая — с радикалом (предельного ряда в предельных альдегидах и непредельного — в непредельных альдегидах). Общая формула альдегидов:
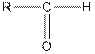
причем R может быть равно Н.
В случае кетонов обе валентности карбонильной группы затрачиваются на соединение с радикалами. Общая формула кетонов:

Изомерия. Номенклатура.
Общая формула предельных альдегидов и кетонов СnН2nO.
Изомерия альдегидов связана со строением радикалов. Так, например, известно четыре альдегида с формулой
 (см. ниже).
(см. ниже).
Альдегиды называют или по кислотам, в которые они переходят при окислении (с тем же числом углеродных атомов), или по предельным углеводородам с добавлением суффикса -аль (систематическая номенклатура).
Примеры:
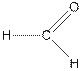
| муравьиный альдегид (формальдегид), метаналь (рис. 1 а) |
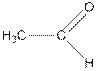
| уксусный альдегид, этаналь (рис. 1 б) |
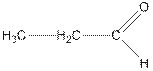
| пропионовый альдегид, пропаналь |
| СН3—СН2—СН2—СНО | масляный альдегид, бутаналь |

| изомасляный альдегид, 2-метилпропаналь |
| СН3—СН2—СН2—СН2—СНО | валериановый альдегид, пентаналь |

| изовалернановый альдегид, 3-метилбутаналь |

| метилэтилуксусный альдегид, 2-метилбутаналь |

| триметилуксусный альдегид, 2,2-диметлпропаналь |
|
Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи. Кетоны называют по наименованию радикалов, связанных с карбонильной группой. По систематической номенклатуре к названию предельного углеводорода добавляется суффикс -он и указывается номер атома углерода, связанного с карбонильным кислородом:

| ацетон (тривиальное название), диметилкетон, пропанон (рис. 2) |

| метилэтилкетон, бутанон |

| метилпропилкетон,2-пентанон |
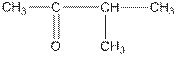
| метилизопропилкетон, 3-метил-2-бутанон |

| диэтилкетон,3-пентанон |
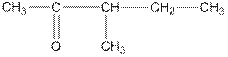
| метил-вторбутилкетон, 3-метил-2-пентанон |
Способы получения
Альдегиды и кетоны получают рядом общих методов.
1. Окислением или каталитическим дегидрированием первичных спиртов получают альдегиды, вторичных — кетоны. Эти реакции уже приводились при рассмотрении химических свойств спиртов.
2. Альдегиды и кетоны удобно также получать пиролизом кислот и их смесей в виде паров над оксидами некоторых металлов (ThО2, МnО2, CaO, ZnO) при 400—450 °С:
R — СООН + Н—СООН→R—СНО + СО2 + Н20
2R—СООН→R —СО —R + C02 + Н20
R—СООН + R' — СООН → R — СО—R’+С02 + Н20
Во многих учебниках указывается, что альдегиды и кетоны могут быть получены пиролизом Са- и Ва-солей карбоновых кислот. В действительности эта реакция дает очень низкие выходы. Однако некоторые метилкетоны все же могут быть получены пиролизом смесей бариевых или железных солей уксусной и какой-либо другой кислоты. Все эти реакции имеют радикальный механизм.
3. Гидролиз геминальных дигалогенопроизводных приводит к альдегидам, если оба галогена находятся у одного из крайних атомов углерода, и кетонам, если атомы галогена находятся у одного из средних атомов углерода. Эти реакции уже упоминались при изучении химических свойств дигалогенопроизводных углеводородов.
4. Гидратация ацетилена и его гомологов в условиях реакции Кучерова приводит соответственно к уксусному альдегиду или кетонам:
НС≡СН + Н2O→ СН3—СНО

5. Карбонильные соединения с высокими выходами (порядка 80%) образуются при окислении соответствующих спиртов смесями дпметилсульфоксида с уксусным ангидридом или безводной фосфорной кислотой.
RCH2OH + (CH3)2SO→ RCH = О + (CH3)2S
6. Превращение галогеналкилов в альдегиды с удлинением цепи на один атом углерода достигается обработкой их натрийтетракарбонилферратом в присутствии трифенилфосфина, а затем уксусной кислотой:
R — Hlg + Na2Fe(CO)4 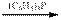 RCOFe(CO3)P(C6H5)3
RCOFe(CO3)P(C6H5)3 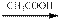 R–CH = О
R–CH = О
Имеется несколько модификаций этого метода.
7. Кетоны с хорошими выходами получаются при взаимодействии хлорангидридов кислот с литийдиалкилкупратамн и кадмийалкилами:
R2CuLi + R'COCI→R — СО — R'+LiCI + R — Сu

8. В технике альдегиды получают прямым присоединением СО и H2 к олефинам (оксосинтез) при 100—200 °С под давлением 10—20 МПа (100—200 атм) в присутствии кобальтового или никелевого катализаторов (например, Со + ThO2 + MgO, нанесенные на кизельгур):

Реакцию с этиленом и пропиленом проводят в газовой фазе, а с более сложными олефинамн (С4—С20) — в жидкой фазе. Как видно из приведенной схемы, при оксосинтезе получаются альдегиды, содержащие на один атом углерода больше, чем исходные олефины. Этот синтез имеет важное значение для получения высших первичных спиртов (каталитическим восстановлением альдегидов). Механизм оксосинтеза можно представить следующим образом:
2Со + 8СО→ Со2(СО)8
Cо2(CO)8 + H2 → 2НСо(СО)4
R —СН=СН2 + НСо(СО)4→ R — СН2—СН2 — Со(СО)4
R — СН2—СН2—Со(СО)4 +СО→ R—СН2—СН2—СО — Со(СО)4
R—СН2—СН2—СО—Со(СО)4 + НСо(СО)4→R—СН2 —СН2—СНО + Со(СО ) 8
Физические свойства
Муравьиный альдегид — газ с весьма резким запахом. Другие низшие альдегиды и кетоны — жидкости, легко растворимые в воде; низшие альдегиды обладают удушливым запахом, который при сильном разведении становится приятным (напоминает запах плодов). Кетоны пахнут довольно приятно.
При одном и том же составе, и строении углеродной цепи кетоны кипят при несколько более высоких температурах, чем альдегиды. Температуры кипения альдегидов и кетонов с нормальным строением цепи выше, чем у соединений изостроения. Например, валериановый альдегид кипит при 103,4 °С, а изовалериановый — при 92,5 °С. Альдегиды и кетоны кипят при температуре, значительно более низкой, чем спирты с тем же числом углеродных атомов, например у пропионового альдегида т. кип. 48,8 °С, у ацетона 65,1 °С, у н -пропилового спирта 97,8 °С. Это показывает, что альдегиды и кетоны в отличие от спиртов не являются сильно ассоциированными жидкостями. В то же время температуры кипения карбонильных соединений значительно выше температур кипения углеводородов с той же молекулярной массой, что связано с их высокой полярностью. Плотность альдегидов и кетонов ниже единицы.
В ИК-спектрах для СО-группы характерно интенсивное поглощение при 1720 см-1. В спектре ЯМР сигнал водорода альдегидной группы находится в очень слабом поле.
Химические свойства
Альдегиды и кетоны отличаются большой реакционной способностью. Большинство их реакций обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя углеродными атомами (σ-связь + π-связь). Однако в то время как Ес=с<2Ес-с, энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых С—О-связей (2х358 кДж/моль). С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы — около 9•10-30 Кл/м (2,7 D). Благодаря такой поляризации углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным. В реакциях присоединения отрицательно поляризованная часть присоединяющейся молекулы всегда направляется к углеродному атому карбонильной группы, в то время как ее положительно поляризованная часть направляется к кислородному атому.
Реакция присоединения нуклеофильных реагентов по месту карбонильной связи — ступенчатый процесс. Схематически реакцию присоединения, например гидросульфита натрия к уксусному альдегиду, можно изобразить следующим образом:
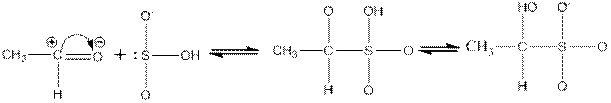
Радикалы, способные увеличивать положительный заряд на атоме углерода карбонильной группы, сильно повышают реакционную способность альдегидов и кетонов; радикалы или атомы, уменьшающие положительный заряд на этом углеродном атоме, оказывают противоположное действие.
Помимо реакций присоединения по карбонильной группе для альдегидов и кетонов характерны также реакции с участием соседних с карбонильной группой углеродных радикалов, обусловленные электроноакцепторным влиянием на них карбонильной группы. К ним относятся реакции окисления, галогенирования, конденсации.
А. Гидрирование. Присоединение водорода к альдегидам и кетонам происходит в присутствии катализаторов гидрирования (Ni, Со, Си, Pt, Pd и др.). При этом альдегиды переходят в первичные, а кетоны — во вторичные спирты. На этом основан один из методов получения спиртов.
В последнее время в качестве восстанавливающего агента часто применяют лнтийалюминийгидрид LiА1Н4. Реакция идет с переносом гидридного иона:
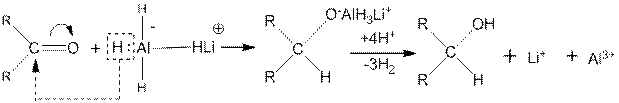
Преимуществом восстановления с помощью LiAlН4 является то, что этот реагент не восстанавливает двойные углерод-углеродные связи.
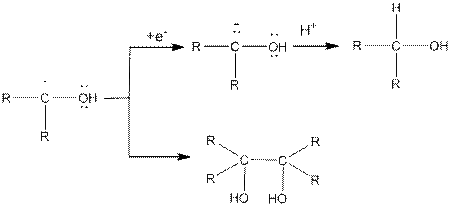
При восстановлении альдегидов или кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамированного магния) образуются наряду с соответствующими спиртами также гликоли:

пинакон
Соотношение между образующимися спиртом и гликолем зависит от природы карбонильного соединения и условий восстановления. При восстановлении кетонов в продуктах реакции в апротонных растворителях преобладают пинаконы; в случае алифатических насыщенных альдегидов гликоли образуются в малых количествах.
Реакция протекает с промежуточным образованием свободных радикалов:

Б. Реакции нуклеофильного присоединения.
1. Присоединение магнийгалогеналкилов подробно разобрано при описании методов получения спиртов.
2. Присоединение синильной кислоты приводит к образованию α-оксинитрилов, омылением которых получают α-гидроксикислоты:

нитрил α-гидроксипропионовой кислоты
Эта реакция начинается нуклеофильной атакой углеродного атома ионом CN-. Цианистый водород присоединяется очень медленно. Добавление капли раствора цианистого калия значительно ускоряет реакцию, в то время как добавление минеральной кислоты уменьшает скорость реакции практически до нуля. Это показывает, что активным реагентом при образовании циангидрина является ион CN-:

3. Присоединение гидросульфита натрия дает кристаллические вещества, обычно называемые гидросульфитными производными альдегидов или кетонов:
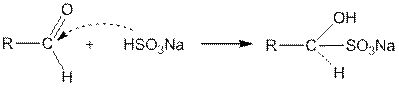

При нагревании с раствором соды или минеральных кислот гидросульфитные производные разлагаются с выделением свободного альдегида или кетона, например:
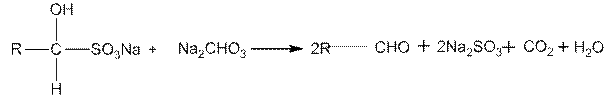 Реакция с гидросульфитом натрия используется для качественного определения альдегидов и кетонов, а также для их выделения и очистки. Следует, однако, заметить, что в реакцию с гидросульфитом натрия в жирном ряду вступают только метилкетоны, имеющие группировку СН3-СО-.
Реакция с гидросульфитом натрия используется для качественного определения альдегидов и кетонов, а также для их выделения и очистки. Следует, однако, заметить, что в реакцию с гидросульфитом натрия в жирном ряду вступают только метилкетоны, имеющие группировку СН3-СО-.
4. Взаимодействие с аммиаком позволяет различать альдегиды и кетоны. Альдегиды выделяют воду, образуя альдимины:
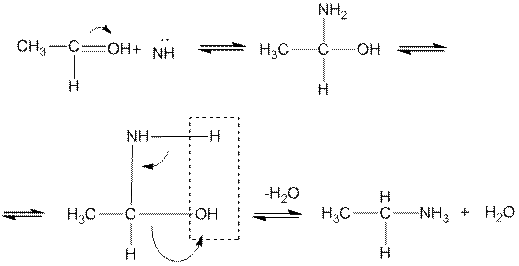
ацетальдимин, этаними н
которые легко полимеризуются (циклизуются в кристаллические тримеры — альдегидаммиаки:
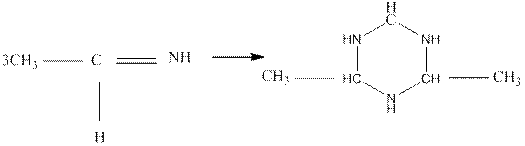
альдегидаммиа к
При циклизации разрывается двойная связь C = N и три молекулы имина соединяются в шестичленный цикл с чередующимися атомами углерода и азота.
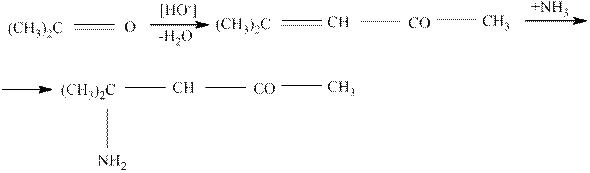
Кетоны с аммиаком подобных соединений не образуют. Они реагируют очень медленно и более сложно, например, так:
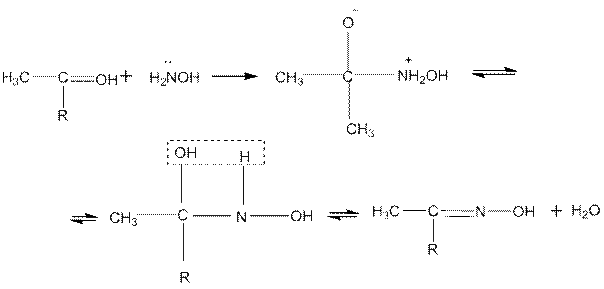
5. С гидроксиламином альдегиды и кетоны, выделяя воду, образуют оксимы (альдоксимы и кетоксимы):

ацетальдоксим

ацетоноксим
Эти реакции применяют для количественного определения карбонильных соединений.
Механизм реакции (R=H или Alk):
6. Особый интерес представляют реакции карбонильных соединений с гидразином и его замещенными. В зависимости от условий гидразин вступает в реакцию с альдегидами и кетонами в соотношении 1:1 или 1:2. В первом случае образуются гидразоны, а во втором — азины (альдазины и кетазины):
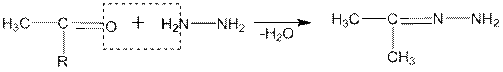
гидразон
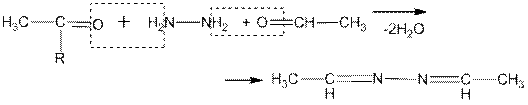
альдазин
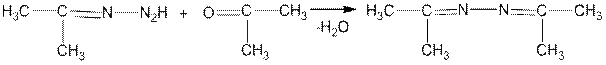 кетазин
кетазин
Гидразоны кетонов и альдегидов при нагревании с твердым КОН выделяют азот и дают предельные углеводороды (реакция Кижнера):

В настоящее время эту реакцию проводят нагреванием карбонильного соединения с гидразином в высококипящих полярных растворителях (ди- и триэтиленгликоли) в присутствии щелочи. Реакция может быть проведена и при комнатной температуре при действии трет-бутилкалия в диметлисульфоксиде.
Альдегиды и кетоны с замещенными гидразинами — с фенилгидразином C6H5—NH—NH2 и семикарбазидом 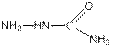 образуют соответственно фенилгидразоны и семикарбазоны. Это кристаллические вещества. Они служат для качественного и количественного определения карбонильных соединений, а также для их выделения и очистки.
образуют соответственно фенилгидразоны и семикарбазоны. Это кристаллические вещества. Они служат для качественного и количественного определения карбонильных соединений, а также для их выделения и очистки.
Образование фенилгидразонов:
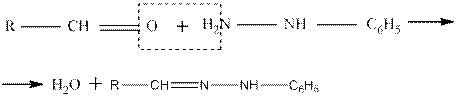
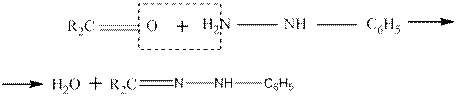
Семикарбазоны образуются по схеме:
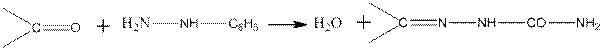
Реакции альдегидов и кетонов с производными гидразина по механизму аналогичны их реакциям с аммиаком и гидроксиламином. Например, для ацетальдегида и фенилгидразина:
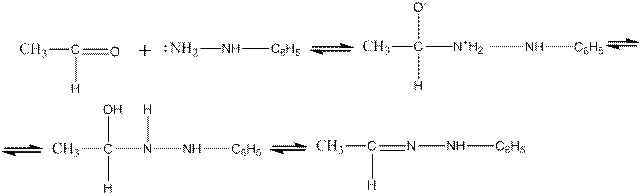
Для этих реакций характерен кислотный катализ.
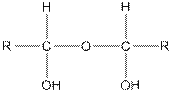
7. Альдегиды и кетоны способны присоединять по карбонильной группе воду с образованием гидратов — геминальных гликолей. Эти соединения во многих случаях существуют только в растворах. Положение равновесия зависит от строения карбонилсодержащего соединения:

Так, формальдегид при 20 °С существует в водном растворе на 99,99% в форме гидрата, ацетальдегид— на 58%; в случае ацетона содержание гидрата незначительно, а хлораль и трихлорацетон образуют стойкие кристаллические гидраты.
Альдегиды с более высокой молекулярной массой образуют с водой устойчивые при низких температурах твердые полугидраты:
8. При действии на альдегиды спиртов образуются полуацетали:
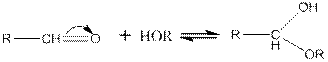
В присутствии следов минеральной кислоты образуются ацетали:
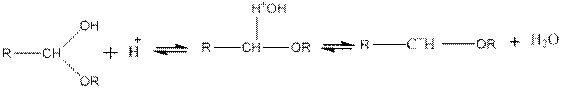

Ацетали — жидкости с приятным эфирным запахом. При нагревании с разбавленными минеральными кислотами (но не щелочами) они подвергаются гидролизу с образованием спиртов и выделением альдегидов:
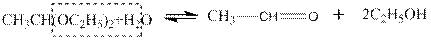
Ацеталь, полученный из масляного альдегида и поливинилового спирта, используется в качестве клея при изготовлении безосколочных стекол.
Ацетали кетонов получаются более сложно — действием на кетоны этиловых эфиров ортомуравьиной НС(ОС2Н5)з или ортокремниевой кислоты:
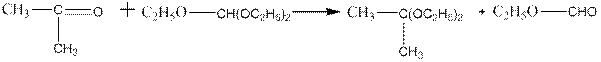
9. При действии на альдегиды спиртов образуются полуацетали:
Альдегиды и кетоны при взаимодействии с PCI5 обменивают атом кислорода на два атома хлора, что используется для получения геминаль- ных дихлоралканов:
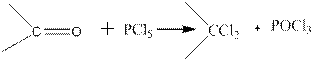
Эта реакция в стадии, определяющей характер конечного продукта, также является реакцией нуклеофильного присоединения:

В. Реакции окисления. Окисление альдегидов идет значительно легче, чем кетонов. Кроме того, окисление альдегидов приводит к образованию кислот без изменения углеродного скелета, в то время как кетоны окисляются с образованием двух более простых кислот или кислоты и кетона.
Альдегиды окисляются кислородом воздуха до карбоновых кислот. Промежуточными продуктами являются гидропероксиды:

Аммиачный раствор гидроксида серебра [Ag(NH3)2]OH при легком нагревании с альдегидами (но не с кетонами) окисляет их в кислоты с образованием свободного металлического серебра. Если пробирка, в которой идет реакция, была предварительно обезжирена изнутри, то серебро ложится тонким слоем на ее внутренней поверхности — образуется серебряное зеркало:

Эта реакция, известная под названием реакции серебряного зеркала, служит для качественного определения альдегидов.
Для альдегидов характерна также реакция с так называемой фелинговой жидкостью. Последняя представляет собой водно-щелочной раствор комплексной соли, образовавшейся из гидроксида меди и натрийкалиевой соли винной кислоты. При нагревании альдегидов с фелинговой жидкостью медь (II) восстанавливается до меди (I), а альдегид окисляется до кислоты:
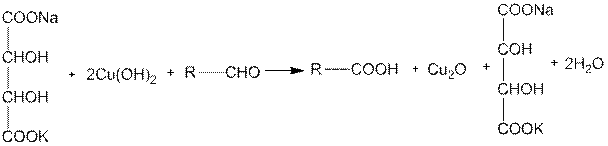
Красная окись меди Cu2О почти количественно выпадает в осадок. Реакция эта с кетонами не идет.
Альдегиды могут быть окислены в карбоновые кислоты с помощью многих обычных окислителей, таких, как дихромат калия, перманганат калия, по ионному механизму, причем первой стадией процесса обычно является присоединение окислителя по СО-группе.
Окисление кетонов протекает с разрывом углеродной цепочки в разных направлениях в зависимости от строения кетонов.
По продуктам окисления можно судить о строении кетонов, а так как кетоны образуются при окислении вторичных спиртов, то, следовательно, и о строении этих спиртов.
Г. Реакции полимеризации. Эти реакции характерны только для альдегидов. При действии на альдегиды кислот происходит их тримеризация (частично и тетрамеризация):
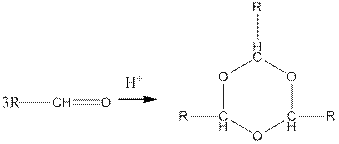
Механизм полимеризации может быть представлен в следующем виде:
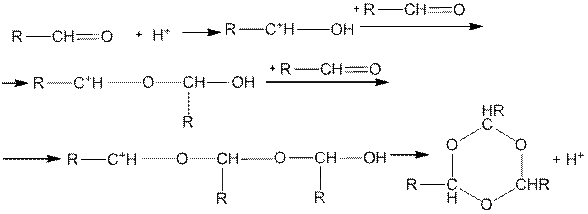
Д. Галогенирование. Альдегиды и кетоны реагируют с бромом и иодом с одинаковой скоростью независимо от концентрации галогена. Реакции ускоряются как кислотами, так и основаниями.
Подробное изучение этих реакций привело к выводу, что они идут с предварительным превращением карбонильного соединения в енол:

Е. Реакции конденсации.
1. Альдегиды в слабоосновной среде (в присутствии ацетата, карбоната или сульфита калия) подвергаются альдольной конденсации (А.П. Бородин) с образованием альдегидосииртов (гидроксиальдегидов), сокращенно называемых альдолями. Альдоли образуются в результате присоединения альдегида к карбонильной группе другой молекулы альдегида с разрывом связи С—Н в α-положении к карбонилу, как это показано на примере уксусного альдегида:

альдоль
В случае альдолизацин других альдегидов, например пропионового, в реакцию вступает только группа, находящаяся в a-положении к карбонилу, так как только водородные атомы этой группы в достаточной степени активируются карбонильной группой:
 3-гидрокси-2-метилпентаналь
3-гидрокси-2-метилпентаналь
Если рядом с карбонилом находится четвертичный атом углерода, альдолизация невозможна. Например, триметилуксусный альдегид (СНз)зС—СНО не дает альдоля.
Механизм реакции альдольной конденсации, катализируемой основаниями, следующий. Альдегид проявляет свойства СН-кислоты. Гидроксильный ион (катализатор) обратимо отрывает протон от а-углеродного атома:

Альдоль при нагревании (без водоотнимающих веществ) отщепляет воду с образованием непредельного кротонового альдегида:
|
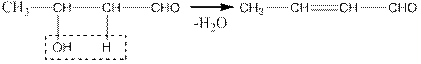
Поэтому переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией. Дегидратация происходит благодаря очень большой подвижности водородных атомов в α-положении по отношению к карбонильной группе (сверхсопряжение), причем разрывается, как и во многих других случаях, p-связь по отношению к карбонильной группе.
При действии на альдегиды, способные к альдольной конденсации, сильных оснований (щелочей) в результате глубокой альдольной (или кротоновой) поликонденсации происходит осмоление. Альдегиды, не способные к альдольной конденсации, в этих условиях вступают в реакцию Канниццаро:
2(СН3)3С—СНО +КОН→(СН3)3С—COOK +(СН3)3С—СН2ОН.
Альдольная конденсация кетонов происходит в более жестких условиях — в присутствии оснований, например Ва(ОН)2. При этом образуются Р-кетоноспирты, легко теряющие молекулу воды:
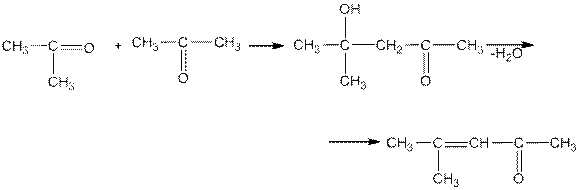
В еще более жестких условиях, например при нагревании с концентрированной серной кислотой, кетоны подвергаются межмолекулярной дегидратации с образованием непредельных кетонов:
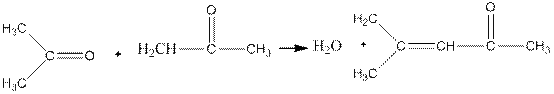 окись мезитила
окись мезитила
Окись мезитила может реагировать с новой молекулой ацетона:

форон
Возможна и конденсация между альдегидами и кетонами, например:
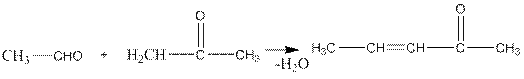
3-пентен-2-он
Во всех этих реакциях вначале идет альдольная конденсация, а затем дегидратация образовавшегося гидроксикетона.
2. Сложноэфирная конденсация альдегидов проходит при действии на них алкгоголятов алюминия в неводной среде (В.Е. Тищенко).
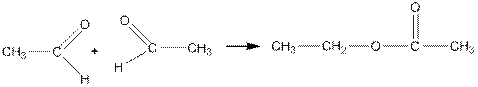
уксусноэтиловый эфир
Ж. Декарбонилирование. Альдегиды при нагревании с трис(трифенилфосфин)родийхлоридом претерпевают декарбонилирование с образованием углеводородов:
R—СНО + [(C6H5)3P]3PhCl→ R—Н + [(C6H5)3P]3RhCOCl.
При изучении химических превращений альдегидов и кетонов необходимо обратить внимание на существенные различия между ними. Альдегиды легко окисляются без изменения углеродной цепи (реакция серебряного зеркала), кетоны окисляются трудно с разрывом цепи. Альдегиды полимеризуются под влиянием кислот, образуют альдегидоаммиаки, со спиртами в присутствии кислот дают ацетали, вступают в сложноэфирную конденсацию, дают окрашивание с фуксинсернистой кислотой. Кетоны не способны к подобным превращениям.
Отдельные представители. Применение
Муравьиный альдегид (формальдегид) — бесцветный газ с резким специфическим запахом, т. кип. -21 °С. Он ядовит, действует раздражающе на слизистые оболочки глаз и дыхательных путей. Хорошо растворим в воде, 40% -ный водный раствор формальдегида называется формалином. В промышленности формальдегид получают двумя методами — неполным окислением метана и его некоторых гомологов и каталитическим окислением или дегидрированием метанола (при 650—700 °С над серебряным катализатором):
СН3ОН→ Н2 +Н2СО.
Благодаря отсутствию алкильного радикала формальдегиду присущи некоторые особые свойства.
1. В щелочной среде он претерпевает реакцию окисления — восстановления (реакция Канниццаро):

2. При легком нагревании формальдегида (формалина) с аммиаком получается гексаметилентетрамин (уротропин), синтезированный впервые А. М. Бутлеровым:
6Н2С=О + 4NH3 → 6H20 + (CH2)6N4
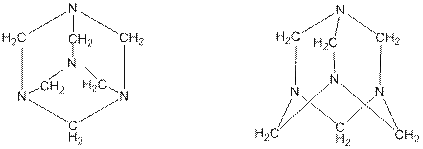
уротропин
Уротропин в больших количествах применяют в производстве фенолформальдегидных смол, взрывчатых веществ (гексогена, получаемого нитрованием уротропина)

гексаген
в медицине (в качестве мочегонного средства, как составная часть антигриппозного препарата кальцекса, при лечении почечных заболеваний и др.).
3. В щелочной среде, например в присутствии известкового молока, как это впервые было показано А. М. Бутлеровым, формальдегид подвергается альдолизации с образованием оксиальдегидов вплоть до гексоз и еще более сложных сахаров, например:
 гексоза
гексоза
В присутствии щелочей формальдегид может конденсироваться и с другими альдегидами, образуя многоатомные спирты. Так, конденсацией формальдегида с уксусным альдегидом получают четырехатомный спирт — пентаэритрит С(СН2ОН)4
СН3СНО + 3Н2СО → (НОСН2)3ССНО
(НОСН2)3ССНО + Н2СО → (НОСН2)4С + НСОО-
Пентаэритрит используется для получения смол и весьма сильного взрывчатого вещества - тетранитропентаэритрита (ТЭН) C(CH2ОNО2)4.
4. Формальдегид способен к полимеризации с образованием циклических и линейных полимеров.
5. Формальдегид способен вступать в различные реакции конденсации с образованием синтетических смол, широко применяемых в промышленности. Так, поликонденсацией формальдегида с фенолом получают фенолформальдегидные смолы, с мочевиной или меламином - карбамидные смолы.
6. Продуктом конденсации формальдегида с изобутиленом (в присутствии H2SO4) является 4,4-диметил-1,3-диоксан, который при нагревании до 200—240 °С в присутствии катализаторов (SiO2 +Н4Р2О7) разлагается с образованием изопрена.
Формалин широко применяется в качестве дезинфицирующего вещества для дезинфекции зерно- и овощехранилищ, парников, теплиц, для протравливания семян и т. д.
Уксусный альдегид, ацетальдегид СН3СНО - жидкость с резким неприятным запахом. Т.кип. 21 °С. Пары ацетальдегида вызывают раздражение слизистых оболочек, удушье, головную боль. Ацетальдегид хорошо растворим в воде и во многих органических растворителях.
Промышленные методы получения ацетальдегида уже были рассмотрены: гидратация ацетилена, дегидрирование этилового спирта, изомеризация окиси этилена, каталитическое окисление воздухом предельных углеводородов.
В последнее время ацетальдегид получают окислением этилена кислородом воздуха в присутствии катализатора по схеме:
CH2=CH2+H2O +PdCl2→CH3—СНО + 2HCl + Pd
Pd + 2CuC12 → 2CuCl + PdCl2
2CuCl + 2HCI + 1 /2O2→ 2CuCI2 + H2O
2CH2 = CH2+ O2 →2CH3CHO
Другие 1-алкены образуют в этой реакции метилкетоны.
Из ацетальдегида в промышленных масштабах получают уксусную кислоту, уксусный ангидрид, этиловый спирт, альдоль, бутиловый спирт, ацетали, этилацетат, пентаэритрит и ряд других веществ.
Подобно формальдегиду, он конденсируется с фенолом, аминами и другими веществами, образуя синтетические смолы, которые используются в производстве различных полимерных материалов.
Под действием небольшого количества серной кислоты ацетальдегид полимеризуется в паральдегид (С2Н4О3)3 и метальдегид (С2Н4О3)4; количества последнего возрастают с понижением температуры (до -10 °С):

Паральдегид — жидкость с т. кип. 124,5 °С, метальдегид — кристаллическое вещество. При нагревании со следами кислоты оба эти вещества деполимеризуются, образуя ацетальдегид. Из паральдегида и аммиака получают 2-метил-5-винилпиридин, используемый при синтезе сополимеров — синтетических каучуков.
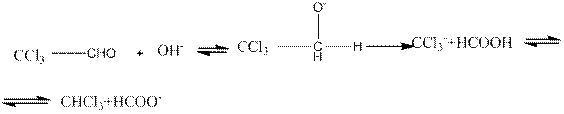
Трихлоруксусный альдегид, хлораль CCI3CHO, получают хлорированием этилового спирта.
Хлораль — бесцветная жидкость с резким запахом; с водой образует кристаллический гидрат — хлоральгидрат. Устойчивость хлоральгидрата объясняется усилением электроноакцепторных свойств карбонильного углерода под влиянием сильного индукционного эффекта хлора:

Обладает снотворным действием. Конденсацией хлораля с хлорбензолом получают в промышленных масштабах инсектициды.
При действии на хлораль щелочей образуется хлороформ:
Ацетон СН3СОСН3— бесцветная жидкость с характерным запахом; Т.кип.=56,1 °С, Т.пл.=0,798. Хорошо растворим в воде и во многих органических растворителях.
Ацетон получают:
1) из изопропилового спирта — окислением или дегидрированием;
2) окислением изопропилбензола, получаемого алкилированием бензола, наряду с фенолом;
3) ацетон-бутанольным брожением углеводов.
Ацетон в качестве растворителя применяется в больших количествах в лакокрасочной промышленности, в производствах ацетатного шелка, кинопленки, бездымного пороха (пироксилина), для растворения ацетилена (в баллонах) и т. д. Он служит исходным продуктом при производстве небьющегося органического стекла, кетена и т. д.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 19908; Нарушение авторских прав?; Мы поможем в написании вашей работы!