
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диальдегиды и дикетоны
|
|
|
|
КЕТЕНЫ
Кетены — своеобразные соединения, напоминающие по строению непредельные кетоны и аллены.
Кетен — первый представитель ряда кетенов. Это газ с резким запахом. Его в больших количествах получают пиролизом ацетона:
СН3—СО—СН3 → СН4 + CН2=С=O.
Кетен не проявляет обычных свойств кетонов — не дает оксима, фенилгидразона, отличается большой склонностью к реакциям присоединения (обычно по связи С=O). При хранении образует димер — дикетен. В промышленности из кетена получают уксусную кислоту, уксусный ангидрид, этилацетат, дикетен, ацетоуксусный эфир и другие соединения.
Диальдегиды и дикетоны — соединения, содержащие две карбонильные группы в молекуле. По взаимному положению этих групп различают α-, β-, γ- и т. д. диальдегиды и дикетоны. Приведем несколько примеров диальдегидов и дикетонов:
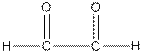
| глиоксаль, этандиаль |
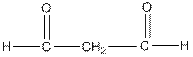
| малоновый альдегид |
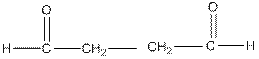
| янтарный альдегид |
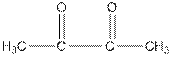
| диацетил, бутандион |
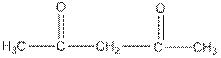
| ацетилацетон, 2,4-пентадион |

| ацетонилацетон, 2,5-гександион |
Глиоксаль получают осторожным окислением таких органических соединений, как спирт, уксусный альдегид, этиленгликоль и др., диоксидом селена или кислородом воздуха в присутствии катализатора:
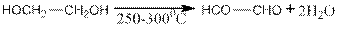
Это твердое вещество желтого цвета с т. пл. 15 °С и т. кип. 50,4 °С; в расплавленном состоянии очень быстро полимеризуется в твердый бесцветный полимер (тример).
Глиоксаль обладает всеми свойствами альдегидов. В реакции может участвовать как одна, так и две карбонильные группы, например:
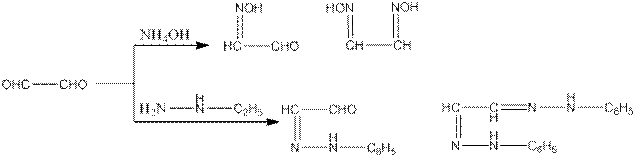
При воздействии концентрированного раствора гидроксида калия глиоксаль превращается в оксиуксусную (гликолевую) кислоту (внутримолекулярное окисление – восстановление, реакция Канниццаро).
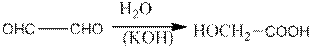
Диацетил получают из метилэтилкетона обработкой азотистой кислотой или ее амиловым эфиром:
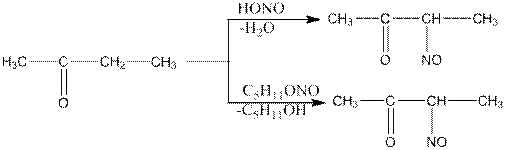
Образующий нитрозокетон изомеризуется в монооксим дикетона:

При кипячении последнего с разбавленной серной кислотой получается диацетил и гидроксиламин:
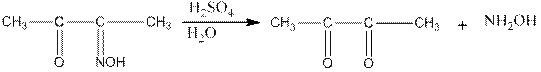
Диацетил – желтая жидкость с острым запахом, температура кипения 880С. Пары диацетила имеют желтый цвет.
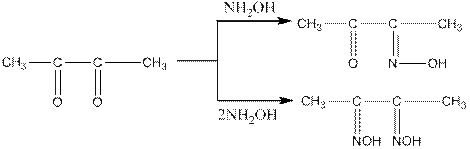
Диацетил обладает свойствами кетонов, причем в реакцию может вступать или одна, или обе карбонильные группы. Например, диацетил с гидроксиаминомможет образовать моно- или диоксим, последний называется диметилглиоксимом:
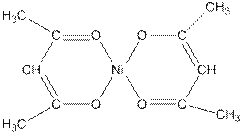
Диметилглиоксим с солями никеля дает яркий красно-фиолетовый кристаллический осадок. Эта реакция, открытая Л.А.Чугаевым, служит для качественного и количественного определения никеля. Осадок – внутрикомплексная соль (клешневидное, хелатное соединение):
Диацетил применяют для придания соответствующего запаха маргаринам или сырам.
Ацетилацетон – жидкость, обладающая приятным запахом, температура кипения 1370С. Получается конденсацией этилацетата с ацетоном в присутствии алкоголята натрия:
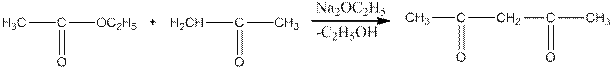
Механизм этой реакции представляется в следующем виде. Анион этилата отщепляет протон от молекулы кетона (кетон является более кислым соединением, чем сложный эфир) с образованием реакционноспособного аниона, который, будучи нуклеофильным реагентом, присоединяется к электрофильному углерода эфира:
|
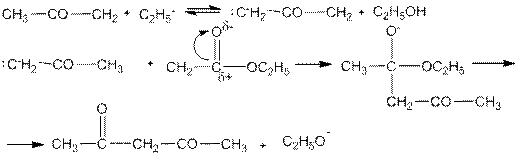
Ацетилацетон, как и другие аналогичные β-дикетоны, реагирует с участием одной или двух карбонильных групп. Но для него характерны и свойства непредельного кетоспирта, что обусловлено способностью β-дикетонов к таутомерному превращению – самопроизвольной обратимой равновесной изомеризации – кето-енольной таутометрии:

Дикетонная форма (15%) кето-енольная форма (85%)
В свободном виде ацетилацетон представляет собой равновесную смесь дикетона и непредельного кетоспирта с сильным преобладанием последнего. Большая устойчивость енольной формы обусловлена возможностью образования внутримолекулярной водородной связи.
В химические превращения ацетилацетона вступает и как дикетон и как непредельный спирт.
Так, например, при взаимодействии с избытком анилина ацетилацетон реагирует как дикетон: в реакцию вступают обе карбонильные группы:

дианил ацетилацетона
С другой стороны, при взаимодействии с металлическим натрием ацетилацетон реагирует как непредельный спирт, образуя енолят. С раствором хлорида железа FеС13 он дает интенсивную окраску, специфическую для соединений, содержащих гидроксильную группу у атома углерода с двойной связью и т. п.
Натрийенолят ацетилацетона при взаимодействии с галогеналкилами превращается в алкилзамещенный ацетилацетон, т.е. наблюдается замещение не у атома кислорода, а у атома углерода:

Это проявление двойственной реакционной способности — амбидентности — аниона алкоголята ацетилацетона:

Другие металлы — железо, медь, алюминий, хром и т. д.— также образуют еноляты. Эти еноляты имеют строение вунтрикомплексных хелатных солей типа:

Многие из них перегоняются или возгоняются без разложения, что было использовано для точного определения валентности некоторых металлов (например, алюминия и бериллия).
Ацетилацетон быстро гидролизуется теплыми едкими щелочами с образованием соли уксусной кислоты и ацетона:
СН3—СО—СН2—СО—CH3 + NaOH → CH3COONa + CH3—CO—CH3.
Процесс идет по следующей схеме:

Список рекомендуемой литературы
1. Реутов О.А. и Курц А.Л., Бутин К.П. Органическая химия. В 4-х частях. Ч. 1: Учебник – М.: МГУ, 1999. – 560 с.
2. Реутов О.А. и Курц А.Л., Бутин К.П. Органическая химия. В 4-х частях. Ч. 2: Учебник – М.: МГУ, 1999. – 624 с.
3. Реутов О.А. и Курц А.Л., Бутин К.П. Органическая химия. В 4-х частях. Ч. 2: Учебник – М.: БИНОМ, 2004. – 544 с.
4. Реутов О.А. и Курц А.Л., Бутин К.П. Органическая химия. В 4-х частях. Ч. 2: Учебник – М.: БИНОМ, 2004. – 726 с.
5. Петров А.А. и др. Органическая химия. – СПб.: «Иван Федоров», 2002.- 624 с.
6. Руководство к лабораторным занятиям по органической химии: Под ред. Н.А. Тюкавкиной. –М.: Дрофа, 2002. – 384 с.
7. Курдюков А.М. Руководство к лабораторным занятиям по органической химии. Под ред. Проф. Рахимова А.И./ ВолгГТУ. - Волгоград, 2005. – 236 с.
8. Практикум по органической химии. Синтез и индентификация органических соединений/ Под ред. О.Ф. Гинзбурга и А.А. Петрова. – М.: Высшая школа, 1989. – 200 с.
9. Гитис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии. – М.: Высш. шк., 1991. – 303 с.
10. Храмкина М.Н. Практикум по органическому синтезу. - Л.: Химия,1988. – 312 с.
11. Сайкс П. Механизмы реакций в органической химии. Пер. с англ. Под ред. Я.М.Варшавского. – М.: Химия, 1973. – 319 с.
12. Альбицкая В.М., Серкова В.И. Задачи и упражнения по органической химии.- М.: Высшая школа, 1983.- 207 с.
13. Нейланд, О. Я. Органическая химия. — М.: Высш. шк., 1990. — 751 с.
ОГЛАВЛЕНИЕ
| Введение | ||
| Список рекомендуемой литературы | ||
| Приложения |

Учебное издание
Сергей Владимирович Дьяконов
Владимир Владимирович Бурмистров
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 8653; Нарушение авторских прав?; Мы поможем в написании вашей работы!