
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Препарата лактатдегидрогеназы по Корнбергу
|
|
|
|
Работа 30. Количественное исследование активности
Реактивы. Фосфатный буфер, 0,1 М с рН 7,4*; пируват натрия, раствор 2∙10-2 М на 0,1 М фосфатном буфере с рН 7,4; НАД∙Н динатриевая соль, свежеприготовленный 6∙10-3 М раствор в дистиллированной воде.
Оборудование. Пипетки вместимостью 0,1; 1 и 5 мл; стеклянная палочка; секундомер; СФ или ФЭК типа КФК-2.
Материал. Разведенный продажный препарат фермента 0,2 мкг/мл. Кристаллический препарат в виде суспензии в 2,2 М растворе сульфата аммония, имеющий активность около 200 ФЕ/мг белка, разводят в 1000 раз 0,1 М фосфатным буфером с рН 7,4 перед опытом (1 ФЕ соответствует 1 мкмоль превращенного субстрата за 1 мин)[2].
Метод основан на непрерывном измерении скорости окисления НАД∙Н2, используемого на восстановление пирувата в реакции, катализируемой ЛДГ. По уменьшению экстинкции НАД∙Н2 при 340 нм рассчитывают количество превращенного субстрата за единицу времени. Лактатдегидрогеназа (ЛДГ) катализирует обратимое превращение пирувата в лактат:
Н
|
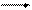 СН3―С―СООН + НАД·Н2 НАД+ + СН3―С―СООН
СН3―С―СООН + НАД·Н2 НАД+ + СН3―С―СООН
║ │
О ОН
пируват лактат
Равновесие реакции сдвинуто вправо, поэтому при изучении ЛДГ удобнее использовать в качестве субстрата пируват и НАД∙Н2 и по скорости окисления последнего рассчитать активность этого фермента.
Ход определения. В кювету спектрофотометра последовательно вносят 2,4 мл фосфатного буфера, 0,2 мл раствора НАД∙Н2 и 0,1 мл образца фермента. Перемешивают стеклянной палочкой и ставят в кюветодержатель.
Устанавливают шкалу отсчета экстинкции на 0,400 и ручкой «щель» выводят стрелку гальванометра (при открытой шторке) на нуль. В течение 1 мин проверяют отсутствие неферментативного окисления НАД∙Н2 (в этом случае экстинкция не падает).
Добавляет в кювету 0,3 мл раствора пирувата натрия (запускают реакцию), быстро перемешивают, ручкой «щель» при открытой шторке возвращают стрелку гальванометра к нулевой отметке и включают секундомер.
Снимают показания экстинкции (падение ее, начиная от отметки 0,400) через каждые 30 с в течение 2-3 мин. Если условия реакции подобраны верно, то за каждые 30 с наблюдается примерно одинаковое уменьшение экстинкции.
Расчет. Удельную активность ЛДГ х (мкмоль∙мин-1∙мг-1) рассчитывают по формуле
∆Емин3,0∙1000
х = ———————,
6,22∙0,02
где ∆Емин – изменение экстинкции в ходе реакции за 1 мин;
6,22 – коэффициент экстинкции 1 мкмоль НАД∙Н2 в 1 мл среды;
3,0 – объем инкубационной смеси, мл;
0,02 – количество белка в кювете, мкг;
1000 – коэффициент пересчета количества белка в миллиграммы.
Оформление работы. Рассчитать удельную активность ферментного препарата, молекулярную активность ЛДГ (учитывая, что ее молекулярная масса 135000). Сделать вывод о качестве исследуемого препарата (сохранность исходной активности, %).
Практическое значение работы. Принципы измерения активности лактатдегидрогеназы спектрофотометрическим методом непрерывного наблюдения используются при исследовании других ферментных препаратов, очищенных ферментов и в клинико-биохимических лабораториях при количественном определении активности ферментов в биологических жидкостях и биоптатах в норме и при патологии.
Работа 31. Фотоколориметрический метод исследования активности лактатдегидрогеназы в сыворотке крови по Севелу и Товареку
Реактивы. Лактат натрия, 0,45 М раствор или нейтрализованная гидроксидом натрия молочная кислота той же концентрации; пирофосфат натрия, 0,03 М раствор (Na4P2O7∙10H2O растворить в 50 мл воды, довести рН до 8,8 с помощью 1 М соляной кислоты и долить водой до 500 мл); НАД, свежеприготовленный раствор 3мг/мл; 2,4-динитрофенилгидразин, 0,2%-ный раствор в 1 М растворе соляной кислоты; гидроксид натрия, 0,4 М раствор; пируват натрия, раствор для построения калибровочного графика (содержит 11 мкг пирувата натрия или 8,8 мкг пировиноградной кислоты в 1 мл).
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1 и 5 мл; ФЭК; водяная баня с лабораторным термометром.
Материал. Сыворотка крови.
Метод основан на определении скорости образования пирувата в ходе окисления лактата с участием лактатдегидрогеназы сыворотки крови:
|
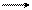 СН3―СН―СООН + НАД+ СН3―С―СООН + НАД·Н2
СН3―СН―СООН + НАД+ СН3―С―СООН + НАД·Н2
│ ║
ОН О
лактат пируват
 |
Пируват с 2,4-динитрофенилгидразином образует соответствующий гидразон, имеющий красно-бурое окрашивание в щелочной среде, интенсивность которого прямо пропорциональна содержанию кетокислоты:
Ход определения. Сыворотку крови разводят в 3 раза дистиллированной водой. Вносят в пробирку 0,1 мл разведенной сыворотки, 0,3 мл раствора НАД+ и ставят на 5 мин в водяную баню при 37˚С (для прогревания смеси).
Во вторую пробирку добавляют 0,8 мл раствора пирофосфата натрия и 0,2 мл раствора лактата натрия и нагревают на водяной бане при 37˚С.
Выливают содержимое второй пробирки в первую, быстро перемешивают стеклянной палочкой, не вынимая пробирки из бани, и отмечают время начала инкубации. Через 25 мин реакцию останавливают, прибавляя 0,5 мл раствора 2,4-ДНФГ, и оставляют пробирку на 20 мин при комнатной температуре (для образования гидразона).
К смеси приливают 5 мл раствора гидроксида натрия, содержимое перемешивают стеклянной палочкой и через 10 мин (после развития окраски) измеряют экстинкцию опытной пробы против контрольной на ФЭКе при длине волны 520-560 нм (светофильтр зеленый) в кювете с толщиной слоя 1 см.
Контрольную пробу готовят как опытную, но разведенную сыворотку добавляют после инкубации.
Расчет. Активность фермента рассчитывают по калибровочному графику, условия построения которого приведены в таблице.
| № пробы | Пируват натрия, мл | Пирофосфат натрия, мл | Дистиллированная вода, мл | Содержание пирувата в пробе, мкмоль | Единицы активности ЛДГ, ммоль/ч∙л | Экстинкция |
| 0,1 | 0,8 | 0,5 | 0,01 | 1,2 | ||
| 0,2 | 0,8 | 0,4 | 0,02 | 2,4 | ||
| 0,4 | 0,8 | 0,2 | 0,04 | 4,8 | ||
| 0,6 | 0,8 | - | 0,06 | 7,2 | ||
| 0,8 | 0,6 | - | 0,08 | 9,6 |
По оси ординат откладывают значения экстинкции, а по оси абсцисс – соответствующие им единицы активности ЛДГ, выраженные в ммоль/(ч∙л).
Оформление работы. Рассчитать активность фермента в исследуемой сыворотке крови, сделать вывод о возможном изменении активности и его причинах.
Практическое значение работы. Определение активности лактатдегидрогеназы используется в клинико-биохимических лабораториях для диагностики и установления прогноза заболевания. В норме активность фермента составляет 0,8-4,0 ммоль/(ч∙л) и возрастает, как правило, у больных с повреждением миокарда, скелетных мышц, почек, а также при анемиях, опухолевых поражениях, остром гепатите и т.д.
Работа 32. Определение активности щелочной фосфатазы
в сыворотке крови по Боданскому
Фосфатазы – ферменты, отщепляющие фосфат от различных субстратов. Среди них имеются энзимы с неодинаковой специфичностью по отношению к субстратам. Щелочная фосфатаза действует в щелочной среде (чем отличается от фосфатаз, осуществляющих катализ в нейтральной или кислой средах) и является малоспецифичной.
Реактивы. β-Глицерофосфат, щелочной раствор на мединаловом буфере с рН 8,6*; трихлоруксусная кислота, 10%-ный раствор; реактив молибдата аммония*; аскорбиновая кислота, 1%-ный раствор на 0,1 М растворе соляной кислоты; дигидрофосфат калия (навеску 0,4394 г KH2PO4, предварительно высушенного в эксикаторе над серной кислотой, взвешивают на аналитических весах и растворяют в колбе вместимостью 100 мл; затем этот раствор разводят в 100 раз и используют для построения калибровочной кривой).
Оборудование. Штатив с пробирками; центрифуга лабораторная с центрифужными весами; пипетки вместимостью 0,2; 1 и 5 мл; водяная баня с лабораторным термометром; ФЭК.
Материал. Сыворотка крови.
Метод основан на фотоколориметрическом определении неорганического фосфора, отщепляемого от β-глицерофосфата под действием фосфатазы сыворотки крови в щелочной среде:
СН2ОН СН2ОН
│ Фосфатаза │
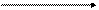 НС―О―РО3Н2 + Н2О НС―ОН + Н3РО4
НС―О―РО3Н2 + Н2О НС―ОН + Н3РО4
│ рН 8,6 │
СН2ОН СН2ОН
β-глицерофосфат глицерин
Неорганический фосфат определяют по образованию фосфомолибдата аммония с последующим восстановлением его в молибденовую синь аскорбиновой кислотой (см. работу 11).
Ход определения. В две пробирки вносят по 1 мл раствора β-глицерофосфата и помещают на 5 мин в водяную баню при 37˚С. Затем в опытную пробирку добавляют 0,2 мл сыворотки крови, перемешивают и отмечают время начала инкубации в водяной бане.
Через 1 час приливают в обе пробирки по 1,8 мл раствора трихлоруксусной кислоты, а в контрольную – еще 0,2 мл сыворотки крови. Перемешивают пробы, оставляют стоять 5 мин для осаждения белка. Центрифугируют содержимое обеих проб в течение 5 мин при 3000 об/мин.
Отбирают в чистые пробирки по 1,5 мл надосадочной жидкости (для определения в ней неорганического фосфата Фн) и приливают по 1 мл реактива молибдата аммония и по 1 мл раствора аскорбиновой кислоты. Через 10 мин измеряют экстинкцию опытной и контрольной проб на ФЭКе, при длине волны 630-690 нм (красный светофильтр) в кювете с толщиной слоя 0,5 см против раствора реактивов (1,5 мл раствора трихлоруксусной кислоты и 1,5 мл дистиллированной воды).
Расчет. Активность фермента рассчитывают по калибровочному графику, условия построения которого приведены в таблице.
| № пробы | Раствор KH2PO4, мл | Н2О, мл | Трихлоруксусн. кислота, мл | Молибдат аммония, мл | Аскорбиновая кислота, мл | Фн в пробе, мг | Активность фермента, ммоль/(ч∙л) |
| 0,1 | 0,9 | 0,5 | 1,0 | 1,0 | 0,001 | 0,32 | |
| 0,2 | 0,8 | 0,5 | 1,0 | 1,0 | 0,002 | 0,64 | |
| 0,4 | 0,6 | 0,5 | 1,0 | 1,0 | 0,004 | 1,29 | |
| 0,6 | 0,4 | 0,5 | 1,0 | 1,0 | 0,006 | 1,93 | |
| 1,0 | - | 0,5 | 1,0 | 1,0 | 0,010 | 3,22 |
По оси ординат откладывают значения экстинкции, а по оси абсцисс – соответствующие единицы щелочной фосфатазы, выраженные в ммоль/(ч∙л).
Оформление работы. По полученным значениям экстинкции найти активность фермента. На основании этого сделать вывод о возможности изменения активности в исследуемой сыворотке и указать на предполагаемые причины.
Практическое значение работы. В клинике используется определение активности щелочной фосфатазы в сыворотке крови в основном у больных с поражениями костной ткани и печени, особенно с явлениями задержки оттока желчи. В норме активность фермента составляет 0,5-1,3 ммоль/(ч∙л). Повышение активности в сыворотке крови наблюдается при рахите (гиповитаминозе D), опухолях костной ткани, гиперпаратиреозе, механической желтухе, вирусном гепатите и т.д., а снижение – при гипотиреозе, гиповитаминозе С и др.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 586; Нарушение авторских прав?; Мы поможем в написании вашей работы!