
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон осмоса
|
|
|
|
Классификации растворов
Существует большое количество классификаций растворов. Ниже приведены наиболее распространенные из них.
1. По агрегатному состоянию растворы делят на жидкие, твердые и газообразные. Если растворитель и растворенное вещество находится в одном агрегатном состоянии, то растворителем считают тот компонент, которого больше.
В соответствии с этой классификацией можно выделить следующие типы растворов: твердое вещество в жидкости; газ в жидкости; жидкость в жидкости; твердое в твердом (твердые растворы) и т.д
2. По размеру частиц (растворитель – жидкость, газ) растворы делят на коллоидные – если размеры частиц больше 1 нм и меньше 100 нм (например, молоко) и истинные – если размеры растворенного вещества меньше 1 нм = 10-9 м. Истинные растворы, в свою очередь делят на молекулярные (раствор сахара в воде) и ионные (раствор хлорида калия в воде).
3. По количеству компонентов растворенного вещества и растворителя: бинарные, тройные и т.д.
4. Важной характеристикой жидких растворов является проводимость (проводят ли электрический ток, содержат ли компоненты, которые способны переносить электричество). Это определяет многие свойства растворов, и, соответственно, дает нам ответ на вопрос какими законами необходимо пользоваться при описании раствора.
С позиции проводимости растворы можно разделить на электролиты и неэлектролиты.
Электролиты – вещества, растворы которых проводят электрический ток и растворенное вещество, преимущественно находится в виде ионов:
АВ +nS⇄ АВ n S ⇄ А+xS + В–(n – x)S,
где S – молекулы растворителя.
Неэлектролиты – вещества, растворы которых не проводят электрический ток и растворимое вещество находится в виде молекул, т.е. не распадается на ионы.
АВ + n S⇄ АВ n S
Для характеристики процесса растворения твердого вещества в жидкости вводят величину коэффициента растворимости (растворимость) – количество вещества (г), растворяющееся в 100 г растворителя.
Если коэффициент растворимостипри 25 ºСменее0,01, то вещество считается нерастворимым. Если коэффициент растворимости менее 1, но более 0,01, то вещество считается малорастворимым. Если коэффициент растворимости более 1, то вещество считается растворимым.
Растворение твердого вещества в жидкости можно представить следующим уравнением:
Втв. ⇄ Вр-р
Если υ пр> υ обр, то преобладает процесс перехода твердого вещества в раствор. Такой раствор содержит растворенного вещества меньше, чем величина его растворимости и называется ненасыщенным. Если υ пр< υ обр, то преобладает процесс выпадения твердого вещества в осадок. Такой раствор содержит растворенного вещества больше, чем величина его растворимости и называется пересыщенным. Если υ пр= υ обр, то система находится в равновесии и такой раствор называется насыщенным.
Растворимость вещества измеряется его содержанием в насыщенном растворе.
Как и всякое физико-химическое равновесие, растворимость зависит от температуры.
Таблица 7.1.1
Способы выражения концентраций растворов
| Название и обозначение | Определение | Формула | Единицы измерения |
| Массовая концентрация ω, % | Число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора | 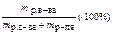
| |
| Молярная концентрация СM | Число молей растворенного вещества, содержащихся в 1 л раствора | 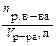
| моль/л |
| Молярная концентрация эквивалента (нормальность) Сн | Число эквивалентов растворенного вещества, содержащихся в 1 л раствора | 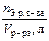
| 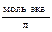
|
| Моляльная концентрация (моляльность) Сm | Число молей растворенного вещества, содержащееся в 1000 г растворителя | 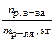 ; ; 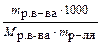
| моль/кг |
| Титр Т | Число граммов растворенного вещества в 1 см3 (мл) раствора | 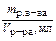
| г/см3 |
| Молярная доля N | Число молей растворенного вещества, отнесенное к общему числу молей | 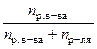
| - |
Процесс растворимости состоит из двух стадий: разрушение кристаллической решетки твердого вещества и процесс взаимодействия растворителя с частицами растворенного вещества (сольватация). Разрушение кристаллической решетки процесс эндотермический (Δ RH > 0, Q < 0); а процесс сольватации экзотермический (Δ solvH < 0, Q > 0). Соответственно, в зависимости от того, изменении энтальпии какой реакции – разрушения кристалла или сольватации – имеет большее значение и будет определяться энтальпия реакции сольватации.
Если | Δ RH | > | Δ solvH |, то процесс растворения является эндотермическим, и при повышении температуры растворимость будет увеличиваться.
Например, Δ раств . Н 0298 (KNO3) = 35,6 кДж/моль.
Если | Δ RH | < | Δ solvH |, то процесс растворения является экзотермическим, и при повышении температуры растворимость будет уменьшаться.
Например, Δ раств . Н 0298 (КОН) = –55 кДж/моль.
Основной характеристикой растворов является концентрация: это отношение количества растворенного вещества к массе или объему растворителя.
В таблице 8.1.1. приведены наиболее распространенные способы выражения концентраций растворов.
В современных лабораториях такие обозначения концентаций не применяют. Все концентрации обозначаются буквой С и отличаются друг от друга единицами измерения.
7.1.2. Коллигативные свойства растворов
Коллигативные свойства растворов – свойства, не зависящие от природы растворенного вещества, а зависящие только от его концентрации. К ним относятся осмотическое давление, понижение давления насыщенного пара над раствором, понижение температуры кристаллизации и повышение температуры кипения растворов. Эти свойства описываются законами Рауля и законом осмоса.
Если имеется некоторый объем жидкости, то над ней всегда присутствуют пары этой жидкости. При постоянных давлении и температуре эти пары находятся в динамическом равновесии с жидкостью. Если в чистый растворитель поместить некоторое количество растворенного вещества, то давление газа над жидкостью уменьшится. Эта зависимость описывается первым законом Рауля: относительное понижение давления насыщенного пара над раствором прямо пропорционально молярной доле растворенного вещества и обратно пропорционально молярной доле растворителя.
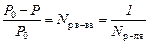 , ,
| (8.1.1) |
где P 0 – давление насыщенного пара растворителя; Р – давление насыщенного пара раствора, N – молярная доля.
Второй закон Рауля: повышение температуры кипения раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации раствора
Δ T кип = E ∙ Cm = 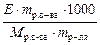 , ,
| (8.1.2) |
где E – эбуллиоскопическая константа, зависящая от природы растворителя (E Н2О = 0,52), Сm – моляльная концентрация раствора (моль/кг).
Третий закон Рауля: понижение температуры замерзания раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации раствора
Δ T зам = К ∙ Cm = 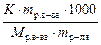 , ,
| (8.1.3) |
где К – криоскопическая константа, зависящая от природы растворителя (К Н2О = 1,86).
Диффузия – это процесс самопроизвольного перемешивания вещества в растворе, приводящий к выравниванию его концентрации в объеме. Осмос -это процесс диффузии молекул вещества через полупроницаемую мембрану, которая обладает свойством пропускать молекулы в одном направлении и не пропускать их при диффузии молекул в обратном направлении.В результате осмоса в системе возникает избыточное давление – осмотическое (π). Его рассчитывают по закону Вант-Гоффа (закону осмоса):
| π = СмRТ, | 8.1.4) |
где См – молярная концентрация раствора, R – газовая постоянная, Т – температура.
Уравнения 8.1.1 – 8.1.4 применимы только к растворам неэлектролитов. Для растворов электролитов в уравнение вводят поправочный коэффициент Вант-Гоффа (i) – изотонический коэффициент.
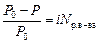 ,
Δ T кип = iECm ,
Δ T кип = iECm
| (8.1.5) (8.1.7) | Δ T зам = iКCm, π = iСмRТ. | (8.1.6) (8.1.8) |
Изотонический коэффициент связан со степенью диссоциации электролита
| i = 1 + a ∙ (ν – 1), | (8.1..9) |
где ν – количество ионов, образующихся при диссоциации одной молекулы.
При большом разбавлении i равен числу ионов, на которые распадается электролит. Например, для раствора LiBr i =2, Na2SO4 – i = 3.
7.2 Свойства растворов электролитов
Распад электролита на ионы под влиянием полярных молекул растворителя (например, воды) называется электролитической диссоциацией.
АВ + n+m Н2О ⇄ АВ (Н2О) n+m ⇄ А+(Н2О) n + В–(Н2О) m
Сольватация – процесс взаимодействия молекул растворителя с частицами (ионами) растворенного вещества; частный случай сольватации – гидратация (если растворитель вода).
А+n(Н2О) – гидратированный ион.
Количественной характеристикой процесса диссоциации является степень электролитической диссоциации.
Степень электролитической диссоциации (a) показывает отношение числа молекул диссоциирующих (распавшихся) на ионы, к общему числу молекул растворенного вещества.
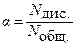 или или 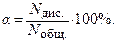
| (8.2.1) |
Степень диссоциации можно представить также как отношение равновесной концентрации ионов, на которые диссоциировала молекула к начальной концентрации электролита:
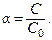
| (8.2.2) |
Степень диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, от концентрации раствора.
С повышением температуры степень диссоциации увеличивается, так как процесс распада молекул происходит с поглощением энергии.
Описать влияние природы растворенного вещества на степень диссоциации можно следующим образом. Электролиты делятся на истинные и потенциальные. Истинные электролиты имеют преимущественно ионный тип связи, их растворы образуются в две стадии: растворение и диссоциация:
КCl тв.+ (n + m)H2O ⇄K+ n (H2O)р-р+ Cl– m (H2O) р-р.
Потенциальные электролиты имеют ковалентный полярный тип связи их растворы образуются в три стадии: растворение, ионизация и диссоциация:
CdCl2 тв.+ (n + m)H2O ⇄ CdCl2(n + m)H2Oр-р⇄
⇄ Cd2+ n (H2O)р-р+ 2Cl– m (H2O) р-р.
По величине степени диссоциации (a) электролиты подразделяются на слабые, средние и сильные (табл. 8.2.1).
Таблица 8.2.1
Классификация электролитов (С = 0,01 М)
| Слабые электролиты | Средние электролиты | Сильные электролиты |
| 0< a <0,03 | 0,03< a <0,3 | a >0,3 |
| Основания: нерастворимые в воде и NH4OH. H2O. Кислоты: CH3COOH, H2CO3, H2S, HCN, H2SiO3, H3BO3 | Кислоты: H2SO3, HF, HNO2, H3PO4 | Основания: LiOH, KOH, NaOH, Sr(OH)2, Ba(OH)2; большинство растворимых солей. Кислоты: HNO3, HCl, HBr, HI, H2SO4, HClO4 |
Сильные электролиты – это вещества, которые при растворении в воде практически полностью распадаются на ионы. В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют. В растворах сильных электролитов диссоциация необратима.
Слабые электролиты – вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. В растворах слабых электролитов диссоциация обратима и существует равновесие между недиссоциированными молекулами и ионами:
АВ ⇄ А+ + В–.
7.2.1. Равновесие в растворах электролитов
Равновесие между недиссоциированными молекулами и ионами описывается соответствующей константой, называемой константой диссоциации.
Константа диссоциации (K д) – отношение произведения равновесных концентраций ионов в степени соответствующих стехиометрических коэффициентов к концентрации недиссоциированных молекул.
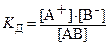 , ,
| (8.2.3) |
где [А+], [В-], [АВ] – равновесные молярные концентрации ионов и недиссоциированных частиц.
Значения констант диссоциации слабых электролитов определены экспериментально и приведены в справочниках. Для сильных электролитов константы отсутствуют, т. к. их диссоциация необратима. Например, диссоциация уксусной кислоты и константа диссоциации выражаются уравнениями:
CH3COOH ⇄ CH3COO–+ H+, 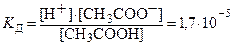 .
.
Если молекула слабого электролита состоит более чем из двух ионов, то его диссоциация идет по ступеням, и каждая ступень характеризуется своей константой диссоциации. Например, диссоциация H2CO3 может протекать в 2 ступени:
1 ступень H2СO3 ⇄ H+ + HСO3–
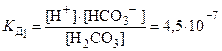
2 ступень: HСO3–⇄ H++ СO32–
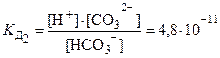
Исходя из значений константы диссоциации, можно оценивать и сравнивать силу электролитов: чем меньше К Д тем слабее электролит, и наоборот.
Для разбавленных растворов слабых электролитов между константой диссоциации, концентрацией раствора и степенью диссоциации существует связь, которая выражается законом разбавления Оствальда: степень диссоциации возрастает с уменьшением концентрации раствора (т.е. при его разбавлении).
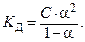
| (8.2.4) |
Если степень диссоциации очень мала a<<1, то (1–a)»1. Следовательно, закон разбавления Оствальда для слабых электролитов принимает вид:
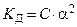 или или 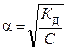 . .
| (8.2.5) |
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 3214; Нарушение авторских прав?; Мы поможем в написании вашей работы!