
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды
Ионно-обменные реакции в растворах электролитов
В разбавленных растворах электролитов (кислот, оснований, солей) между ионами могут протекать химические реакции, не сопровождающиеся изменениями степеней окисления. Они называются реакциями ионного обмена.
Ионно-обменные реакции протекают практически необратимо, если образуются малорастворимые вещества (они выпадают в осадок), легколетучие вещества (они выделяются в виде газа) или малодиссоциирующие вещества – слабые электролиты (в том числе вода), комплексные соединения.
Ионообменные реакции записывают обычно с помощью молекулярного, полного ионного и краткого ионного уравнений. Например, молекулярное уравнение:
Pb(NO3)2 + 2HI = PbI2↓ + 2HNO3;
ионное уравнение:
Pb2++ 2NO3–+ 2H++ 2I– = PbI2↓ + 2H++ 2NO3–;
сокращенное ионное уравнение:
Pb2++ 2I– = PbI2↓.
Вода – очень слабый электролит, поэтому на ионы диссоциирует в незначительной степени:
Н2О ⇄ Н++ ОН–.
Для данного равновесия на основе закона действия масс, можно записать константу равновесия – константу диссоциации воды (КД):
 или К д × [ Н2О] = [Н+] × [ ОН–].
или К д × [ Н2О] = [Н+] × [ ОН–].
Обозначая К д × [Н2О] через К В, получим:
К В= [Н+]×[ОН–]
К В– называют ионным произведением воды. При 25 °С К В= 1·10–14, тогда
| [Н+]×[ОН–] = 1·10–14 | (8.2.6) |
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. В чистой воде при 25 оС
[H+] = [ОН–] = 1·10–7моль/л
Раствор, в котором концентрация ионов водорода равна концентрации гидроксид-ионов называют нейтральным. Если концентрация [Н+] > [ОН –], то такой раствор называют кислым. Если концентрация [Н+] < [ОН–], то раствор называют щелочным.
Кислотность или щелочность раствора выражают другим более удобным способом: вместо концентраций ионов водорода [H+] и гидроксид-ионов используют их десятичный логарифм, взятый с обратным знаком:
| рН = – lg [Н+], рОН = – lg [ОН–]. | (8.2.7) |
Соответственно,
| рН + рОН = 14. | (8.2.8) |
Величина рН называется водородным показателем и для характеристики среды раствора используется чаще:
рН > 7 – среда щелочная;
рН < 7 – среда кислая;
рН ≈ 7 – среда нейтральная.
При использовании величин концентраций часто наблюдается отклонение от закона действующих масс, в основном для сильных электролитов. Поэтому вместо концентраций пользуются активностями электролита (а). Отличие активности электролита от концентрации связано с частичной или полной диссоциацией его молекул на ионы, появлением сил электростатического взаимодействия этих ионов, взаимодействием ионов с молекулами растворителя. Активность связана с концентрацией через коэффициент активности (γ):
| а = С ∙ γ | (8.2.9) |
Коэффициент активности – работа против сил, вызывающих отклонение свойств раствора от свойств идеальных растворов. Например, рН = – lg aH+.
Установлено, что в малоконцентрированных растворахкоэффициент активности иона определяется только электростатическими взаимодействиями. Следовательно, γ зависит только от концентрации электролита и заряда иона и не зависит от природы электролита. Мерой электростатического взаимодействия является ионная сила раствора (I).
Связь коэффициента активности электролита с ионной силой раствора описывает предельный закон Дебая-Хюккеля:
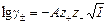 , ,
|
где А – коэффициент, зависящий от температуры и диэлектрической постоянной растворителя Для воды при 298К А = 0,509. Обычно для приближенных расчетов рассчитывают ионную силу раствора и на основании этого определяют коэффициент активности по справочным данным:
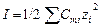 , ,
| (8.2.10) |
|
|
Дата добавления: 2014-11-06; Просмотров: 683; Нарушение авторских прав?; Мы поможем в написании вашей работы!