
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Так как КОН сильный электролит, то рН следует рассчитывать с учетом ионной силы раствора, т.е
|
|
|
|
Решение
Так как КОН сильный электролит, то рН следует рассчитывать с учетом ионной силы раствора, т.е. через активность.
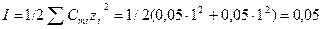 .
.
По справочным данным (приложение 5) находим коэффициент активности, соответствующий этой ионной силе:
γ = 0,85, тогда а (ОН–) = γ∙С ОН–= 0,85∙0,05=0,043 и
рОН= –lg С ОН–=1,37, рН=14 – рОН = 14 – 1,37 = 12,63.
Пример 10. Рассчитайте рН и рОН 0,001 М раствора Pb(NO3)2, учитывая только первую ступень гидролиза.
рН = – lg [Н+].
Запишем уравнение гидролиза нитрата свинца по первой ступени:
Pb(NO3)2 + Н2О ⇄ PbOHNO3 + HNO3
Pb2+ + 2NO3–+ Н2О ⇄ PbOH+ + NO3–+ H+ + NO3–
Pb2+ + Н2О ⇄ PbOH+ + H+
Таким образом, концентрация Н+обусловлена диссоциацией образующего сильного электролита – азотной кислоты. Чтобы найти концентрацию Н+необходимо знать степень гидролиза нитрата свинца. Воспользуемся упрощенной формулой закона Оствальда:
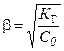 ;
; 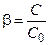
В приложении находим К ДО2= 3,0 ∙10–8. Обратите внимание, что в данном случае используется константа диссоциации основания по второй ступени.
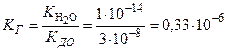 ,
,
отсюда
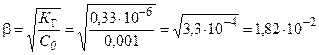 ;
;
С = β С 0 = 1,82∙10–2 ∙0,001 = 1,82∙10–5.
рН = – lg [1,82∙10–5] = 5 + 0,26 = 5,26,
рОН = 14 – 5,26 = 8,74.
Пример 11. Выпадет ли осадок гидроксида меди при добавлении 100 мл 0,01 М раствора гидроксида кальция к равному по объему 0,001 М раствору сульфата меди?
Cu2++ 2OH–⇄ Cu(OH)2↓
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1224; Нарушение авторских прав?; Мы поможем в написании вашей работы!