
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия электрохимических процессов
|
|
|
|
Электрохимическими процессами называют процессы взаимного превращения химической и электрической форм энергии. Электрохимические процессы можно разделить на две основные группы: процессы превращения химической энергии в электрическую (в гальванических элементах); процессы превращения электрической энергии в химическую (электролиз).
Электрохимические реакции, протекающие в гальванических элементах и при электролизе, проходят на границе раздела веществ, имеющих ионную (например, растворы электролитов) и электронную проводимость (например, металлы).
Рассмотрим процессы, протекающие на границе раздела металл – раствор соли металла. При погружении металла в раствор начинается взаимодействие металла с компонентами раствора:
M ⇄ M n + + nе–.
Прямая реакция – окисление металла и диффузия его гидратированных ионов в раствор, обратная реакция – восстановление ионов металла из раствора на поверхности металлического кристалла.
Рассмотрим случай, когда скорость прямой реакции больше скорости обратной. Металл, окисляясь, оставляет в кристалле электроны. Поверхность металла из-за избытка электронов заряжается отрицательно. Положительно заряженные ионы из раствора (катионы металла, диполи воды) притягиваются к отрицательной поверхности металла, на границе возникает двойной электрический слой (рис. 9.3.1, а).
В случае, если скорость обратной реакции больше скорости прямой, катионы соли, восстанавливаясь на поверхности металлической поверхности, «обедняют» ее электронами и металл заряжается положительно. Отрицательно заряженные ионы из раствора (анионы соли металла, диполи воды) притягиваются к положительно заряженной поверхности металла, на границе возникает двойной электрический слой (рис. 9.3.1, б).
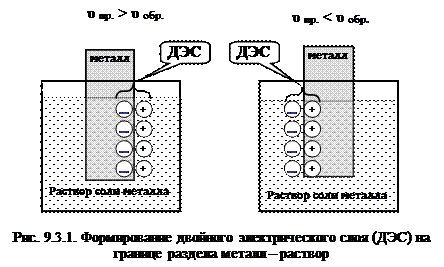
Таким образом, между металлом и раствором в условиях равновесия возникает разность потенциалов, которая называется равновесным электродным потенциалом. Абсолютные значения электродных потенциалов экспериментально определить невозможно, их можно только сравнить.
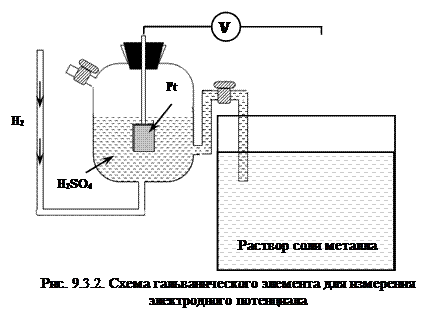
В качестве электрода сравнения используют водородный электрод. Потенциал стандартного водородного электрода при температуре 298 K условно принимают равным нулю.
Водородный электрод состоит из платинированной платины, полученной нанесением на поверхность платины слоя высокодисперсной платины, контактирующей с газообразным водородом, находящимся под давлением 100 кПа, и раствором, в котором концентрация ионов Н+ равна единице. При контакте платины с молекулярным водородом происходит адсорбция водорода на платине. Адсорбированный (поглощенный поверхностью) водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на водородном электроде можно записать в виде
2Н+ + 2 е– ⇄ Н2.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, состоящий из водородного электрода и исследуемого металла (рис. 9.3.2).
Электродный потенциал металла, измеренный по отношению к водородному электроду при стандартных условиях (т. е. при концентрации ионов металлов в растворе 1 моль/л и температуре 298 К), называют стандартным электродным потенциалом металла (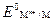 , В). Значения стандартных электродных потенциалов металлов – справочная величина.
, В). Значения стандартных электродных потенциалов металлов – справочная величина.
Если условия отличаются от стандартных, то для расчета электродных потенциалов используют уравнение Нернста:
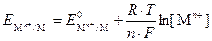 , ,
| (9.3.1) |
где 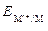 – электродный потенциал металла, В;
– электродный потенциал металла, В; 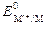 – его стандартный электродный потенциал, В; R – универсальная газовая постоянная (8,314 Дж /(моль·К)); T – температура, К; n – число электронов, принимающих участие в процессе; F – число Фарадея (96485 Кл/моль); [M n +] – концентрация ионов в растворе, моль/л.
– его стандартный электродный потенциал, В; R – универсальная газовая постоянная (8,314 Дж /(моль·К)); T – температура, К; n – число электронов, принимающих участие в процессе; F – число Фарадея (96485 Кл/моль); [M n +] – концентрация ионов в растворе, моль/л.
Переходя от натурального логарифма к десятичному и подставляя в уравнение (9.3.1) соответствующие значения R, F и Т = 298 К, получаем
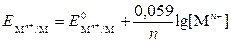 . .
| (9.3.2) |
Согласно уравнению Нернста потенциал металлического электрода зависит от концентрации ионов металлов в растворе, от температуры и от природы металла.
Потенциалы газовых электродов. Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металл является только электронным проводником и не принимает участия в окислительно-восстановительных реакциях (электрохимически инертен), например, платина и платиновые металлы, графит, стеклоуглерод. Так как в равновесных электродных реакциях участвуют газообразные компоненты, то электродные потенциалы этих электродов зависят от парциальных давлений газов.
Потенциалы окислительно-восстановительных (редокси-) электродов. К окислительно-восстановительным (редокси-) электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из металлического проводника, контактирующего с раствором, содержащим окислители и восстановители. К металлу в редокси-электродах предъявляются те же требования, что и к металлическому проводнику в газовых электродах.
В общем виде равновесие на электроде для простых систем записывается уравнением
Ox + n е– ® Red,
Red – n е– ® Ox,
где Ox – окисленная форма вещества; Red – восстановленная форма вещества.
Уравнение Нернста для расчета потенциала редокси-электрода имеет вид
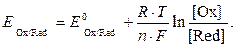
| (9.3.3) |
Значения стандартных потенциалов редокси-электродов можно найти в справочниках. Потенциал окислительно-восстановительных электродов служит мерой окислительной и восстановительной способности систем. Окислительная способность систем возрастает со сдвигом редокси-потенциала в сторону положительных значений. Восстановительная способность систем растет со сдвигом потенциала в сторону отрицательных значений.
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2905; Нарушение авторских прав?; Мы поможем в написании вашей работы!