
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванический элемент
|
|
|
|
Если мы опустим цинковую пластинку в раствор сульфата меди, то произойдет реакция
Zn + CuSO4 = Zn SO4+ Cu.
В результате реакции выделится теплота (Q). То есть химическая энергия перейдет в теплоту. Можно перевести химическую энергию в электрическую.
Гальванический элемент – устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую энергию.
Основным отличием электрохимических реакций, протекающих в гальваническом элементе, от окислительно-восстано-вительных реакций является пространственное разделение процессов окисления и восстановления.
Наиболее распространенным является гальванический элемент, состоящий из двух связанных между собой электродов, представляющих собой металлические пластины, погруженные в раствор электролита (растворы или расплавы солей с одноименным ионом).
Рассмотрим работу гальванического элемента Даниэля–Якоби (рис. 9.5.1), состоящего из двух электродов – цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.
При разомкнутой цепи в этом гальваническом элементе устанавливается равновесие между цинковым электродом и раствором сульфата цинка, а также между медным электродом и раствором сульфата меди. При замыкании внешней цепи электроны перемещаются от электрода с более низким потенциалом (цинкового) к электроду с более высоким потенциалом (медному).
На цинковом электроде протекает реакция окисления, и ионы переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением первой полуреакции
Zn – 2 e – = Zn2+.
На медном электроде протекает восстановление ионов меди: электроны, переместившиеся к нему от цинкового электрода, соединяются с находящимися в растворе ионами меди; образуются атомы меди, выделяющиеся в элементной форме на пластине металла. Соответствующая вторая полуреакция –
Cu2++ 2 e – = Cu0.
Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций
Cu2+ + 2 e – + Zn0– 2 e – = Zn2+ + Cu0.
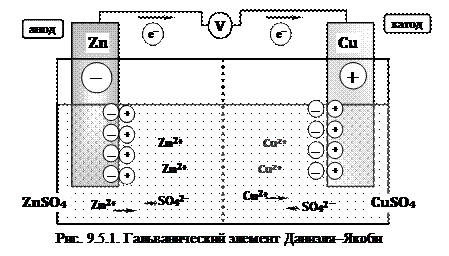
Направление движения ионов в растворе обусловлено протекающими у электродов электрохимическими процессами. Как было упомянуто выше, у цинкового электрода катионы (положительные заряженные ионы) выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами и заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы (Zn2+ и Cu2+) движутся от цинкового электрода к медному, а анионы – SO42– – в обратном направлении. В итоге жидкость у обоих электродов остается электронейтральной.
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов – электродвижущая сила (ЭДС). ЭДС любого гальванического элемента равна разности потенциалов двух его электродов (катода и анода):
| ЭДС = Е к – Е а > 0, | (9.5.1) |
где Е к – электродный потенциал катода; Е а – электродный потенциал анода. ЭДС любого работающего гальванического элемента – величина положительная.
Анод – электрод, на котором происходит процесс отдачи электронов (окисление); в гальваническом элементе анод заряжен отрицательно. Катод – электрод, на котором происходит процесс присоединения электронов (восстановление); в гальваническом элементе катод заряжен положительно.
Потенциал катода больше потенциала анода, соответственно, в медно-цинковом элементе цинковый электрод является анодом, а медный – катодом.
Для элемента Даниэля–Якоби при стандартных условиях и при [Zn2+] = [Cu2+] = 1 моль/л
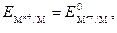
поэтому ЭДС =  В.
В.
Схема цепи гальванического элемента записывается в виде
(–) Zn | Zn2+|| Cu2+| Cu (+)
или
(–) Zn | ZnSO4|| CuSO4 | Cu (+).
Слева записывается анод, а справа – катод. Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного. В круглых скобках знаками «плюс» и «минус» обозначают полюсы электродов.
Концентрационный гальванический элемент представляет собой металлический гальванический элемент, составленный из двух одинаковых по природе электродов, погруженных в растворы своих солей с различными концентрациями. Например, серебряный гальванический элемент
(–) Ag | AgNO3 (0,001 M) || AgNO3 (0,1M) | Ag (+).
Здесь левый электрод с меньшей концентрацией является анодом, а правый – с большей концентрацией – катодом.
В некоторых случаях металл электрода не претерпевает изменений в ходе электродного процесса, а участвует только в передаче электронов от восстановленной формы вещества к его окисленной форме. Так, в гальваническом элементе
(–) Pt | Fe+2, Fe+3 || MnO4–, Mn+2 , H+ |Pt (+)
роль инертных электродов играет платина. На платиновом аноде окисляется железо (II):
Fe+2 = Fe+3 + e –,
а на платиновом катоде восстанавливается марганец (VII):
MnO4–+ 8H++ 5 e – = Mn+2+ 4H2O.
Умножив первое из этих уравнений на пять и сложив со вторым, получаем суммарное уравнение протекающей реакции:
5Fe+2+ MnO4–+ 8H+= 5Fe+3+ Mn+2+ 4H2O.
Согласно уравнению 9.3.3. можно рассчитать электродные потенциалы и, соответственно, ЭДС полученного гальванического элемента.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 3374; Нарушение авторских прав?; Мы поможем в написании вашей работы!