
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 2. Примеры решения задач
|
|
|
|
Пример 1
Примеры решения задач
Составить уравнение реакции восстановления оксида железа углем по реакции Fe2O3 + C = Fe + CO.
Решение. Железо восстанавливается, понижая степень окисления от +3 до 0; углерод окисляется, его степень окисления повышается от 0 до +2. Составим схемы этих процессов, указывая степень окисления элементов.
Отношение чисел электронов, участвующих в восстановлении и окислении, равно 3:2. Следовательно, в реакции каждые два атома железа восстанавливаются тремя атомами углерода.
| Fe+3+ 3 e – = Fe0 | восстановление, Fe+3– окислитель; | |
| C0– 2 e – = C+2 | 3 | окисление, C+2– восстановитель. |
Окончательно получаем:
Fe2O3 + 3C = 2Fe + 3CO.
Гальванический элемент состоит из металлического цинка, погруженного в 0,1 моль/л раствор нитрата цинка, и металлического свинца, погруженного в 0,02 моль/л раствор нитрата свинца. Вычислить ЭДС элемента, написать уравнения электродных процессов, составить схему элемента.
Решение. Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы. Для этого находим значения стандартных электродных потенциалов систем (прил. 2):
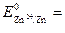 –0,76 В и
–0,76 В и 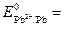 –0,13 В,
–0,13 В,
а затем рассчитываем значения электродного потенциала по уравнению Нернста (9.3.2):
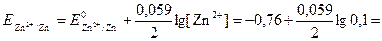
= –0,76 + 0,030(–1)= –0,79 В,
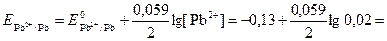
= –0,13 + 0,03(–1,7) = –0,18 В.
Поскольку 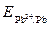 >
>  , то на свинцовом электроде будет происходить восстановление, т. е. он будет служить катодом:
, то на свинцовом электроде будет происходить восстановление, т. е. он будет служить катодом:
Pb+2 + 2 e – = Pb0.
На цинковом электроде будет происходить процесс окисления, т. е. этот электрод будет анодом:
Zn0 – 2 e – = Zn2+.
Находим ЭДС элемента:
ЭДС= 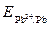 –
–  = –0,18 – (–0,79) = 0,61 В.
= –0,18 – (–0,79) = 0,61 В.
Схема гальванического элемента имеет следующий вид:
(–) Zn | Zn(NO3)2 (0,1 моль/л) || (0,02 моль/л) Pb (NO3)2 | Pb (+).
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1197; Нарушение авторских прав?; Мы поможем в написании вашей работы!