
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи для самостоятельного решения. Ток силой 6 А пропускали через водный раствор нитрата калия в течение 1,5 ч
|
|
|
|
Пример 7
Ток силой 6 А пропускали через водный раствор нитрата калия в течение 1,5 ч. Вычислить массу разложившейся воды и объем выделившихся кислорода и водорода (условия нормальные).
Решение. Запишем электродные процессы при электролизе нитрата калия.
| Катод (–): | 2H2O + 2 e – → H2 + 2OH–, |
| Анод (+): | 2H2O – 4 e – → O2 + 4H+. |
Массу разложившейся воды находим из закона Фарадея, имея в виду 1,5 ч = 5400 с.
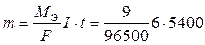 = 3,02 г,
= 3,02 г,
где
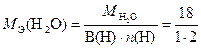 = 9 г/моль экв.
= 9 г/моль экв.
При вычислении объемов выделившихся газов используем закон Фарадея, записанный через объемы. Так как при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода – 5,6 л/моль, то получим
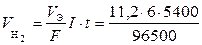 = 3,76 л;
= 3,76 л;
 = 1,88 л.
= 1,88 л.
321–340. Для данной реакции подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
321. KClO3 + Na2SO3 + = KCl + Na2SO4.
322. Au + HNO3 + HCl = AuCl3 + NO + H2O.
323. P + HNO3 + H2O = H3PO4 + NO.
324. Cl2 + I2 + H2O = HCl + HIO3.
325. MnS + HNO3 = MnSO4 + NO2 + H2O.
326. HCl + HNO3 = Cl2 + NO + H2O.
327. H2S + HNO3 = S + NO + H2O.
328. HClO4 + SO2 + H2O = HCl + H2SO4.
329. As + HNO3 = H3AsO4 + NO2 + H2O.
330. KI + KNO2 +H2SO4 = I2 + NO + K2SO4 + H2O.
331. KNO2 + S = K2S + N2 + SO2.
332. HI + H2SO4 = I2 + H2S + H2O.
333. H2SO3 + H2S = S + H2O.
334. H2SO3 + H2S = S + H2O.
335. Cr2(SO4)3 + Br2 + KOH = K2CrO4 + KBr + K2SO4 + H2O.
336. P + H2SO4 = H3PO4 + SO2 + H2O.
337. H2S + Cl2 + H2O = H2SO4 + HCl.
338. P + HIO3 + H2O = H3PO4 + HI.
339. NaAsO2 + I2 + NaOH = Na3AsO4 + HI.
340. K2Cr2O7 + SnCl2 + HCl = CrCl3 + SnCl4 + KCl + H2O.
341. Составьте гальваническую цепь, имея в распоряжении Cu, Pb, CuCl2 и Pb(NO3)2. Напишите уравнения электродных процессов и вычислите ЭДС этого элемента (концентрации растворов равны 1 моль/л).
Ответ: ЭДС = 0,463 В.
342. Составьте схему гальванического элемента, состоящего из железной и оловянной пластинок, погруженных в растворы хлоридов железа (II) и олова (II) соответственно. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента (концентрации растворов равны 1 моль/л).
Ответ: ЭДС = 0,314 В.
343. Гальванический элемент составлен по схеме: Ni | NiSO4 (0,1 M) || AgNO3 (0,1 M) | Ag. Напишите уравнения электродных процессов и вычислите ЭДС этого элемента.
Ответ: ЭДС =1,019 В.
344. Составьте схему гальванического элемента, состоящего из железной и ртутной пластинок, погруженных в растворы своих солей. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента (концентрации растворов равны 1 моль/л).
Ответ: ЭДС =1,294 В.
345. Из четырех металлов Ag, Cu, Al и Sn выберите те пары, которые дают наименьшую и наибольшую ЭДС составленного из них гальванического элемента.
Ответ: пара Cu и Ag имеет минимальную ЭДС,
пара Al и Ag – максимальную ЭДС.
346. Составьте схему двух гальванических элементов, в одном из которых свинец являлся бы катодом, а в другом – анодом. Напишите уравнения электродных процессов и вычислите ЭДС каждого элемента.
347. Составьте схему гальванического элемента, состоящего из свинцовой и цинковой пластинок, погруженных в растворы своих солей, где [Pb2+] = [Zn2+] = 0,01 моль/л. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,637 В.
348. Составьте схему гальванического элемента, состоящего из алюминиевой и цинковой пластинок, погруженных в растворы своих солей, где [Al3+] = [Zn2+] = 0,1 моль/л. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,899 В.
349. Составьте схему гальванического элемента, у которого один электрод никелевый с [Ni2+] = 0,1 моль/л, а второй – свинцовый с [Pb2+] = 0,0001 моль/л. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС =0,035 В.
350. Составьте схему гальванического элемента, состоящего из цинковой пластинки, погруженной в 0,1 М раствор нитрата цинка, и свинцовой пластинки, погруженной в 1 М раствор нитрата свинца. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,666 В.
351. Составьте схему гальванического элемента, у которого один электрод никелевый с [Ni2+] = 0,1 моль/л, а второй – свинцовый с [Pb2+] = 0,0001 моль/л. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,035 В.
352. Составьте схему гальванического элемента, состоящего из кадмиевой пластинки, погруженной в 0,1 М раствор сульфата кадмия, и серебряной пластинки, погруженной в 0,01 М раствор нитрата серебра. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 1,113 В.
353. Составьте схему гальванического элемента, состоящего из двух алюминиевых пластинок, опущенных в растворы его соли с концентрацией [Al3+] = 1 моль/л у одного электрода и [Al3+] = 0,1 моль/л у другого электрода. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,029 В.
354. Составьте схему гальванического элемента, состоящего из двух серебряных электродов, опущенных в 0,0001 моль/л и 0,1 моль/л растворы AgNO3. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,563 В.
355. Напишите уравнения электродных процессов, суммарную реакцию и вычислите ЭДС гальванического элемента Ni | NiSO4 (0,01 M) || Cu(NO3)2 (0,1 M) | Cu.
Ответ: ЭДС = 0,596 В.
356. Составьте схему гальванического элемента, состоящего из кадмиевой пластинки, погруженной в 0,1 М раствор нитрата кадмия, и серебряной пластинки, погруженной в 1 М раствор нитрата серебра. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 1,233 В.
357. Составьте схему гальванического элемента, состоящего из двух алюминиевых пластинок, опущенных в растворы его соли с концентрацией [Al3+] = 1 моль/л у одного электрода и [Al3+] = 0,01 моль/л у другого электрода. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,059 В.
358. Составьте схему гальванического элемента, состоящего из двух медных электродов, опущенных в 0,001 М и 0,1 М растворы Сu(NO3)2. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,059 В.
359. Составьте схему гальванического элемента, состоящего из двух никелевых пластинок, опущенных в растворы никелевой соли с концентрацией [Ni2+] = 1 моль/л у одного электрода и [Ni2+] = 0,01 моль/л у другого электрода. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,059 В.
360. Составьте схему гальванического элемента, состоящего из двух свинцовых электродов, опущенных в 0,001 моль/л и 1 моль/л растворы Pb(NO3)2. Напишите уравнения электродных процессов и вычислите ЭДС данного элемента.
Ответ: ЭДС = 0,088 В.
361. В результате пропускания тока через водный раствор сульфата цинка в течение 5 ч выделилось 6 л кислорода. Определите силу тока. Напишите уравнения реакций, протекающих на инертных электродах при электролизе ZnSO4.
Ответ: I = 5,74 A.
362. В какой последовательности будут разряжаться на катоде ионы металлов при электролизе расплавов смеси солей KCl, ZnCl2, MgCl2. Ответ поясните.
Ответ: ZnCl2 (D E =2,122 B), MgCl2 (D E = 3,72 B),
KCl (D E = 4,28 B).
363. В результате пропускания тока силой 1,2 А через водный раствор соли двухвалентного металла в течение 1 ч выделилось 2,52 г металла. Определите атомную массу этого металла.
Ответ: M (Сd) = 112,5 г/моль.
364. Сколько граммов меди выделится на катоде при пропускании через раствор сульфата меди тока силой 5 А в течение 10 минут?
Ответ: m (Cu) = 0,987 г.
365. Напишите уравнения реакций, протекающих на инертных электродах при электролизе хлорида калия, находящегося: а) в расплаве; б) в растворе.
366. При электролизе раствора сульфата меди с медными электродами масса катода увеличилась на 40 г. Какое количество электричества (в кулонах) было пропущено через раствор?
Ответ: Q = 121574,8 Кл.
367. Кадмий какой массы выделился на катоде, если через раствор сульфата кадмия пропустили ток силой 3,35 А в течение 1 ч?
Ответ: m (Cd) = 7 г.
368. Серебро какой массы выделилось на катоде, если через раствор нитрата серебра пропустили электрический ток силой 0,67 А в течение 20 ч?
Ответ: m (Ag) = 53,9 г.
369. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора CuCl2: а) с инертным анодом; б) с медным анодом.
370. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора Zn(NO3)2: а) с инертным анодом; б) с цинковым анодом.
371. Какое количество хлора выделится на аноде в результате пропускания тока силой 5 А через раствор хлорида серебра в течение 1 ч?
Ответ: V (Cl2) = 2 л.
372. Какое количество никеля выделится при пропускании тока силой 5 А через раствор нитрата никеля в течение 5,37 ч? Напишите уравнения реакций, протекающих на инертных электродах.
Ответ: m (Ni) = 29,4 г.
373. При электролизе раствора сульфата никеля выделяется 4,2 л кислорода (н.у.). Сколько граммов никеля выделится на катоде?
Ответ: m (Ni) = 22 г.
374. Какое количество электричества потребуется для получения 44,8 л водорода при электролизе водного раствора хлорида калия? Напишите уравнения реакций, протекающих на инертных электродах.
Ответ: Q = 386000 Кл.
375. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 7 А через раствор нитрата серебра в течении 30 мин.
Ответ:m (Ag) = 14 г.
376. Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А?
Ответ:53,6 ч.
377. Найти объем кислорода (н.у.), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН.
Ответ:V (О2) = 627 мл.
378. Найти объем водорода (н.у.), который выделится при пропускании тока силой в 3 А в течение 1 ч через водный раствор Н2SO4.
Ответ:V (Н2) = 1,25 л.
379. При электролизе водного раствора SnCl2 на аноде выделилось 4,48 л хлора (н.у.). Найти массу выделившегося на катоде олова.
Ответ:m (Sn) = 23,7 г.
380. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла.
Ответ:Ar (In) = 114,8 а.е.м.
Контрольные вопросы
1. Что называют гальваническим элементом? Описать принцип его работы.
2. Что такое стандартный электродный потенциал?
3. Что такое электродвижущая сила гальванического элемента? Как рассчитывается ЭДС гальванического элемента для стандартных условий и условий, отличных от стандартных?
4. В чем отличие металлических и концентрационных гальванических элементов?
5. Какие процессы протекают при работе гальванического элемента, состоящего из железного и серебряного электродов, опущенных в растворы своих солей?
6. Составьте схемы гальванических элементов, в которых ртутный электрод является: а) анодом; б) катодом.
7. Что такое электролиз?
8. Назовите продукты электролиза водного раствора нитрата меди на нерастворимом аноде.
9. Дайте определение явления перенапряжения. Когда оно возникает?
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2605; Нарушение авторских прав?; Мы поможем в написании вашей работы!