
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов. Коррозия – это самопроизвольный процесс разрушения материалов и изделий из них в результате физико-химического воздействия окружающей среды
|
|
|
|
Коррозия – это самопроизвольный процесс разрушения материалов и изделий из них в результате физико-химического воздействия окружающей среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
Металлы и сплавы, приходя в соприкосновение с окружающей средой (газообразной или жидкой), подвергаются разрушению. Скорость коррозии металлов и металлических покрытий в атмосферных условиях определяется комплексным воздействием ряда факторов: наличием на поверхности адсорбированной влаги, загрязненностью воздуха коррозионно-агрессивными веществами, изменением температуры воздуха и металла, природой продуктов коррозии и т. д.
Согласно законам химической термодинамики коррозионные процессы возникают и протекают самопроизвольно лишь при условии уменьшения энергии Гиббса системы (∆ G <0).
91.1.Классификация коррозионных процессов
1. По типу разрушений коррозия бывает сплошной и местной. При равномерном распределении коррозионных разрушений она не представляет собой опасности для конструкций и аппаратов, особенно в тех случаях, когда потери металлов не превышают технически обоснованных норм. Местная коррозия гораздо опаснее, хотя потери металла могут быть и небольшими. Опасность состоит в том, что, снижая прочность отдельных участков, она резко уменьшает надёжность конструкций, сооружений, аппаратов.
2. По условиям протекания различают: атмосферную, газовую, жидкостную, подземную, морскую, почвенную коррозию, коррозию блуждающими токами, коррозию под напряжением и др.
3. По механизму коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия может протекать при взаимодействии с сухими газообразными окислителями и растворами неэлектролитов. С газами большинство металлов взаимодействует при повышенных температурах. При этом на поверхности протекают два процесса: окисление металла и накопление продуктов окисления, которые иногда предотвращают дальнейшую коррозию. В общем виде уравнение реакции окисления металлов кислородом выглядит следующим образом:
x M + y /2 O2 = M x O y. (1)
Энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов, т. к. ∆ G образования простых веществ равна 0. Для реакции окисления (1) она равна
∆ G= ∆ G 0 – 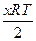 ln p O2,
ln p O2,
где ∆ G 0 – стандартная энергия Гиббса реакции; p O2– относительное давление кислорода.
Способы защиты от газовой коррозии: легирование металлов, создание защитных покрытий на поверхности и изменение свойств газовой среды.
Электрохимическая коррозия металлов развивается при контакте металла с растворами электролитов (все случаи коррозии в водных растворах, т. к. даже чистая вода является слабым электролитом, а морская вода – сильным). Основные окислители – это вода, растворенный кислород и ионы водорода.
Причина электрохимической коррозии состоит в том, что поверхность металла всегда является энергетически неоднородной из-за наличия примесей в металлах, различий по химическому и фазовому составу сплава и др. Это приводит к образованию на поверхности во влажной атмосфере микрогальванических элементов. На участках металла, имеющих более отрицательное значение потенциала, происходит процесс окисления этого металла:
М0+ nе –=М n +(анодный процесс).
Окислители, принимающие электроны у катода, называются катодными деполяризаторами. Катодными деполяризаторами служат: ионы водорода (водородная деполяризация), молекулы кислорода (кислородная деполяризация).
На катодных участках поверхности происходит восстановление окислителей (табл. 10.1.1).
Таблица 10.1.1
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 925; Нарушение авторских прав?; Мы поможем в написании вашей работы!