
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Гидролизом соли называется процесс взаимодействия ионов соли с ионами воды с изменением рН среды
|
|
|
|
Гидролизом соли называется процесс взаимодействия ионов соли с ионами воды с изменением рН среды. Обязательным условием гидролиза является образование малодиссоциированного вещества (слабого электролита).
Качественно реакцию среды определяют с помощью индикаторов. Выделяют четыре типа реакций взаимодействия солей с водой:
1. Соль, образованная ионами сильного основания (катионами) и сильной кислоты (анионами), гидролизу не подвергается. Растворы таких солей имеют нейтральную среду рН ≈ 7.
K2SO4 + H2O ≠
2. Соль, образованная катионами сильного основания и анионами слабой (средней) кислоты, гидролизуется по аниону (рН раствора >7).
KCN + H2O ⇄ KOH + HCN,
ионное уравнение: K++ CN– + H2O ⇄ K++ OH–+ HCN,
сокращенное ионное уравнение CN–+ H2O ⇄ OH–+ HCN.
3. Соль, образованная катионами слабого основания и анионами сильной кислоты, гидролизуется по катиону (рН < 7).
NH4Cl + H2O ⇄ NH4OH + HCl,
ионное уравнение NH4++ Cl–+ H2O ⇄ NH4OH + H++ Cl–,
сокращенное ионное уравнение NH4++ H2O ⇄ NH4OH +H+.
4. Соль, образованная катионами слабого основания и анионами слабой кислоты, гидролизуется полностью до образования слабой кислоты и слабого основания (рН раствора ≈7).
NH4CN + H2O → NH4ОН + HCN.
Гидролиз солей, образованных многозарядными ионами протекает ступенчато. Например, гидролиз фосфата натрия протекает в три ступени:
1-я ступень: Na3PO4 + H2O ⇄ Na2HPO4 + NaOH;
ионное уравнение:
3Na++PO43–+ H2O ⇄ 2Na++ HPO42–+ Na++ OH–;
2-я ступень Na2HPO4 + H2O ⇄ NaH2PO4+ NaOH;
ионное уравнение
2Na++НPO42–+H2O ⇄ Na++ H2PO4–+ Na++OH–;
3-я ступень NaH2PO4+ H2O ⇄ H3PO4+ NaOH;
ионное уравнение
Na+ +Н2PO42- + H2O ⇄ H3PO4 + Na+ + OH–;
Гидролиз хлорида меди протекает в две ступени:
1-я ступень CuCl2 + H2O ⇄ CuOHCl + HCl;
ионное уравнение
Cu2++ 2Cl–+ H2O ⇄ CuOH++ Cl–+ H++ Cl–;
2-я ступень: CuOHCl + H2O ⇄ Cu(OH)2 + HCl;
ионное уравнение
CuOH+ + Cl–+ H2O ⇄ Cu(OH)2 + H+ + Cl–.
При комнатной температуре соли гидролизуются, как правило, только по 1 ступени, за исключением солей, образованных катионом слабого основания и анионом слабой кислоты.
Количественно реакция гидролиза характеризуется степенью гидролиза b и константой гидролиза К Г. Степень гидролиза представляет отношение концентрации гидролизованных молекул к общей концентрации вещества. Степень гидролиза зависит от температуры и концентрации веществ. Константа равновесия реакции гидролиза называется константой гидролиза. Она связана со степенью гидролиза следующим уравнением:
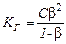
| (8.2.11) |
Константа гидролиза связана с ионным произведением воды через константы диссоциации слабых электролитов:
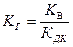 – гидролиз соли, образованной катионами сильного основания и анионами слабой (средней) кислоты; – гидролиз соли, образованной катионами сильного основания и анионами слабой (средней) кислоты;
| (8.2.12) |
 – гидролиз соли, образованной катионами слабого основания и анионами сильной кислоты; – гидролиз соли, образованной катионами слабого основания и анионами сильной кислоты;
| (8.2.13) |
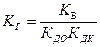 – гидролиз соли, образованной катионами слабого основания и анионами слабой кислоты. – гидролиз соли, образованной катионами слабого основания и анионами слабой кислоты.
| (8.2.14) |
В уравнениях (8.2.12 – 8.2.14) К ДО – константа диссоциации слабого основания, К ДК – константа диссоциации слабой кислоты.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 614; Нарушение авторских прав?; Мы поможем в написании вашей работы!