
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Мольная масса серной кислоты равна 98 г/моль
Мольная масса серной кислоты равна 98 г/моль. Следовательно,
M э(H2SO4) = 98: 2 = 49 г экв./моль.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
СM = (12 ∙ 1,08∙10) / 98 = 1,32 моль/л.
б) Молярная концентрация эквивалента 12% раствора серной кислоты равна
СН = (12 ∙ 1,08 ∙ 10) / 49 = 2,64 моль экв./л.
Пример 5. Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в молярную концентрацию эквивалента и наоборот. Для пересчета из одной концентрации в другую можно использовать формулу:
СM = СН ∙ f э
Молярная концентрация 0,5 н. Na2CO3
СM = 0,5 ∙ 1/2 = 0,25 моль/л
Пример 6. Раствор, содержащий 3,04 г камфары С10Н16О в 100 г бензола, кипит при 80,714 ˚С. Температура кипения бензола 80,2˚С. Вычислите эбуллиоскопическую константу бензола.
Решение
Так как раствор камфары в бензоле это раствор неэлектролита, то для решения воспользуемся формулой 8.1.3.
Δ T кип = 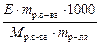 , отсюда
, отсюда
Е = 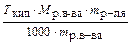 , M (С10Н16О) = 152 г/моль,
, M (С10Н16О) = 152 г/моль,
Е = 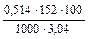 = 2,57 º.
= 2,57 º.
Пример 7. При 20 ºС осмотическое давление водного раствора, в 100 мл которого содержится 6,33 г гематина, равно 243,4 кПа. Определите молярную массу гематина.
Решение
Для решения воспользуемся формулой 8.1.4. Найдем из нее молярность раствора
СМ = π / RТ =243,4/(8,31∙293) = 0,1 моль/л.
Теперь вычисли молярную массу гематина. В 100 мл воды содержится 6,33 г гематина, значит в 1000 мл (1 л) 63,3 г. Отсюда 63,3 это 0,1 моль, а 1 моль составит 633 г:
М (гематина) = 633 г/моль.
Пример 8. Рассчитайте рН 0,002 М раствора Н2СО3.
|
|
Дата добавления: 2014-11-06; Просмотров: 1132; Нарушение авторских прав?; Мы поможем в написании вашей работы!