
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения заданий. Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?
|
|
|
|
Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?

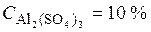 • Масса 1 л раствора равна
• Масса 1 л раствора равна
 ρp =1,105 г/мл
ρp =1,105 г/мл 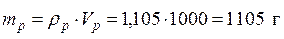
CM –? • Рассчитаем массу Al2(SO4)3 в 1105 г раствора, исходя из формулы (1):
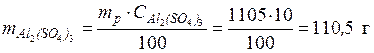
• Молярная масса 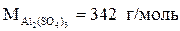 , следовательно, молярная концентрация сульфата алюминия исходя из формулы (4):
, следовательно, молярная концентрация сульфата алюминия исходя из формулы (4):
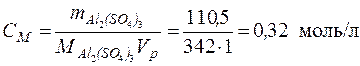
Пример 2. Чему равна массовая доля 0,2 М раствора (NH4)2SO4 с плотностью 1,015 г/мл?

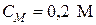 • Масса 1 л раствора равна
• Масса 1 л раствора равна
 ρp =1,015 г/мл
ρp =1,015 г/мл 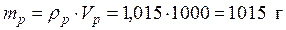
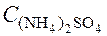 –? • Рассчитаем массу (NH4)2SO4 в 1 л раствора,
–? • Рассчитаем массу (NH4)2SO4 в 1 л раствора,
используя формулу (4) (молярная масса 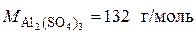 ):
):
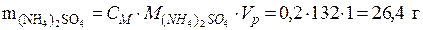
• Массовая доля сульфата алюминия в растворе по формуле (1):
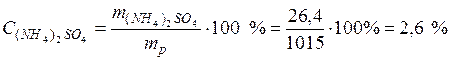
Пример 3. Смешали 50 мл 10 %-го раствора серной кислоты плотностью 1,069 г/мл и 150 мл 30 %-го раствора той же кислоты, плотностью 1,224 г/мл. Чему равна массовая доля кислоты в конечном растворе?
Условная схема приготовления конечного раствора:
раствор 1 (10 %) + раствор 2 (30 %) = раствор 3 (? %)

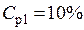 • Массовая доля серной кислоты, исходя из (1):
• Массовая доля серной кислоты, исходя из (1):
ρp1 =1,069 г/мл 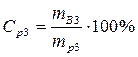
Vp1 = 50 мл • Исходя из того, что масса конечного раствора складывается
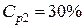 из масс исходных растворов, а масса растворенной в нем
из масс исходных растворов, а масса растворенной в нем
ρp2 =1,224 г/мл кислоты – из масс кислоты в исходных растворах, получаем:
 Vp2 = 150 мл
Vp2 = 150 мл 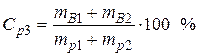
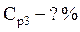 • Используя значения плотностей растворов и выражение (1), найдем массы исходных растворов и растворенной в них серной кислоты:
• Используя значения плотностей растворов и выражение (1), найдем массы исходных растворов и растворенной в них серной кислоты:
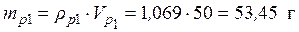
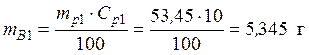
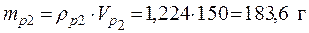
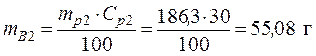
• Найдем массовую долю серной кислоты в конечном растворе:
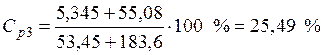 .
.
Пример 4. Какой объем 40 %-го раствора азотной кислоты плотностью 1,251 г/мл и воды потребуется для приготовления 500 мл 20 %-ой кислоты плотностью 1,119 г/мл?
Условная схема приготовления раствора:
раствор 1 (40 %) + вода = раствор 2 (20 %)
 |
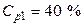 • Необходимый объем исходного раствора кислоты выразим из (2):
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1 =1,251 г/мл 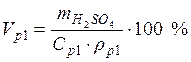
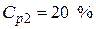 • В полученном выражении неизвестна масса кислоты, но при
• В полученном выражении неизвестна масса кислоты, но при
ρp2 =1,119 г/мл разбавлении исходного раствора водой масса растворенной
 Vp2 = 500 мл кислоты не изменяется, поэтому ее можно вывести из
Vp2 = 500 мл кислоты не изменяется, поэтому ее можно вывести из
Vp1–? мл выражения массовой доли раствора 2:
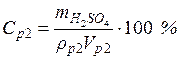
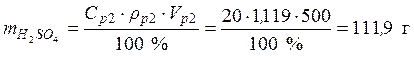
• Рассчитаем объем исходного раствора:
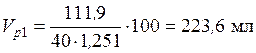
• Исходя из схемы получения конечного раствора:
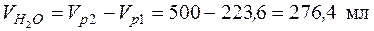
Пример 5. Какой объем 10 %-го раствора КОН плотностью 1,082 г/мл потребуется для приготовления 2 л 1 М раствора?
Условная схема приготовления раствора:
раствор 1 (10 %) + вода = раствор 2 (1 М)
 |
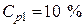 • Необходимый объем исходного раствора кислоты выразим из (2):
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1 =1,082 г/мл 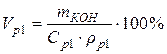
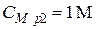 • В полученном выражении неизвестна масса щелочи, но при
• В полученном выражении неизвестна масса щелочи, но при
 Vp2 = 2 л разбавлении исходного раствора водой масса растворенной
Vp2 = 2 л разбавлении исходного раствора водой масса растворенной
Vp1 –? мл щелочи не изменяется, поэтому ее можно вывести из
выражения молярной концентрации раствора 2:
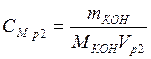 ;
; 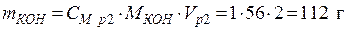
• Рассчитаем объем исходного раствора:
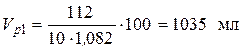
5.2. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1. Какой объем 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) требуется для приготовления 2 л 5 %-го раствора той же кислоты (ρ = 1,02 г/мл)?
2. Определить молярную концентрацию концентрированной соляной кислоты
(ρ = 1,183 г/мл), содержащей 36 % хлороводорода.
3. Какой объем 50 %-го раствора KOH (ρ = 1,538 г/мл) требуется для приготовления 3 л 10 %-го раствора (ρ = 1,082 г/мл)?
4. Плотность 32 %-го раствора KOH равна 1,31 г/мл. Сколько моль KOH находится в 3 л раствора?
5. Какой объем 28 %-го раствора серной кислоты (ρ = 1,21 г/мл) можно приготовить из 100 г 92 %-го раствора?
6. К 1 л 6 %-го раствора серной кислоты (ρ = 1,04 г/мл) добавили 1 л воды. Вычислить молярную концентрацию полученного раствора.
7. Какой объем 50 %-го раствора H2SO4 (ρ = 1,4 г/мл) требуется для приготовления 2 л 1 М раствора?
8. Смешали 50 мл 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) и 150 мл 30 %-го раствора той же кислоты (ρ = 1,152 г/мл). Какова массовая доля HCl в полученном растворе?
9. Сколько граммов K2SO4 необходимо для приготовления 500 мл 0,1 М раствора?
10. Какой объем 20 %-го раствора NaОН плотностью 1,225 г/мл потребуется для приготовления 1 л 2 М раствора?
11. Смешали 500 г 10 %-го раствора и 300 г 30 %-го раствора H2SO4. Какова процентная концентрация полученного раствора?
12. Смешали 50 мл 30 %-го раствора азотной кислоты плотностью 1,286 г/мл и 50 мл 50 %-го раствора той же кислоты плотностью 1,316 г/мл. Чему равна массовая доля кислоты в конечном растворе?
13. Какой объем 1 М раствора хлорида натрия можно приготовить из 20 г безводного NaCl?
14. Какой объем 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) необходим для приготовления 3 л 1,5 М раствора?
15. К 1 л 10 %-го раствора NaOH (ρ = 1,115 г/мл) прибавили 3 л воды. Какова процентная концентрация полученного раствора?
16. Какая масса сульфата натрия требуется для приготовления 500 мл 0,2 М
раствора?
17. 100 мл 2 М раствора разбавили водой до 400 мл. Какова молярная концентрация раствора?
18. Из 600 г 5 %-го раствора соды (Na2CO3) выпариванием удалили 100 г воды. Какова массовая доля Na2CO3 в полученном растворе?
19. Вычислить объем 10 %-го раствора NaOH (ρ = 1,115 г/мл), который требуется для приготовления 1 л 1 М раствора.
20. В каком объеме 0,2 М раствора содержится 10 г NiSO4?
21. Смешали 20 мл 20 %-го раствора азотной кислоты (ρ = 1,119 г/мл) и 100 мл 30 %-го раствора той же кислоты (ρ = 1,184 г/мл). Вычислить процентную концентрацию полученного раствора.
22. Какая масса хлорида натрия содержится в 100 мл 1 М раствора?
23. Какой объем 10 %-го раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 3 л 5 %-го раствора (ρ = 1,05 г/мл)?
24. Вычислить молярную концентрацию 25 %-го раствора сульфата цинка
(ρ = 1,3 г/мл).
25. Какой объем 30 %-й соляной кислоты (ρ = 1,152 г/мл) нужно взять для приготовления 1 л 2 М раствора?
26. Какой объем воды надо прибавить к 100 мл 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) для получения 20 %-го раствора?
27. Какая масса KNO3 должна быть растворена в 500 мл воды для получения 5 %-го раствора?
28. К 2 л 10 %-го раствора азотной кислоты (ρ = 1,054 г/мл) добавили 3 л
4 %-го раствора той же кислоты (ρ = 1,022 г/мл). Вычислить процентную концентрацию полученного раствора.
29. Вычислить молярную концентрацию 20 %-го раствора сульфата железа (II) (ρ = 1,21 г/мл).
30. К 50 мл 96 %-го раствора азотной кислоты (ρ = 1,5 г/мл) прилили 30 мл 9,9 М раствора той же кислоты (ρ = 1, 3 г/мл). Какова процентная концентрация полученного раствора?
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 6341; Нарушение авторских прав?; Мы поможем в написании вашей работы!