
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения заданий
|
|
|
|
Ионные реакции
Ионные реакции – это реакции в водных растворах электролитов, не сопровождающиеся изменением степеней окисления атомов элементов.
При составлении ионных уравнений реакций:
· сильные растворимые электролиты записывают в виде ионов;
· слабые электролиты, малорастворимые (осадки) и газообразные вещества записывают в молекулярной форме.
Реакции ионного обмена протекают при выполнении одного из условий: в качестве продукта реакции должен получиться осадок, газ или слабый электролит.
Примеры реакций ионного обмена:
· с образованием слабых электролитов:
HCl + NaOH = NaCl + H2O
H+ + Cl– + Na+ + OH– = Na+ + Cl– + H2O
H+ + OH– = H2O
CH3COONa + HCl = NaCl + CH3COOH
CH3COO– + Na+ + H+ + Cl– = Na+ + Cl– + CH3COOH
CH3COO– + H+ = CH3COOH
· с образованием малорастворимых веществ:
AgNO3 + NaCl = AgCl + NaNO3
Ag+ + NO3– + Na+ + Cl– = AgCl + Na+ + NO3–
Ag+ + Cl– = AgCl
· c образованием газообразных веществ:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2Na+ + CO32– + 2H+ + SO42– = 2Na+ + SO42– + H2O + CO2↑
CO32– + 2H+ = H2O + CO2↑.
Пример 1. Напишите уравнения диссоциации предложенных электролитов: H3BO3, HClO4, Сo(OH)2, Sr(OH)2, Sn(OH)2, Na2SO4, Ca(HCO3)2.
Для слабых электролитов составьте выражения констант диссоциации.
При составлении уравнений диссоциации следует учесть, что суммарный заряд в обеих частях уравнения должен быть одинаков.
H3BO3 является слабой кислотой, поэтому диссоциация протекает ступенчато (в три ступени) и обратимо, при отщеплении каждого последующего иона H+ заряд образовавшейся частицы становится на единицу меньше чем исходной:
H3BO3  H+ + H2BO3–
H+ + H2BO3–
H2BO3–  H+ + HBO32–
H+ + HBO32–
HBO32–  H+ + BO33–
H+ + BO33–
Для слабого электролита составим выражение константы диссоциации – в числителе указываем произведение концентраций продуктов диссоциации, а в знаменателе – исходных частиц:

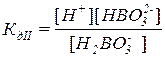
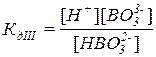
HClO4 – сильная кислота, диссоциирует практически, в уравнении диссоциации ставят знак равенства:
HClO4 = H+ + ClO4–
Для сильного электролита выражение константы диссоциации не составляют.
Co(OH)2 – cлабое основание, диссоциирует обратимо и ступенчато отщепляя на каждой ступени по одной гидроксогруппе, заряд оставшейся частицы при этом становится на единицу больше исходной
Co(OH)2  CoOH+ + OH–
CoOH+ + OH–
CoOH+  Co2+ + OH–
Co2+ + OH–
Для слабого электролита составим выражение константы диссоциации – в числителе указываем произведение концентраций продуктов диссоциации, а в знаменателе – исходных частиц:
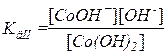
 .
.
Sr(OH)2 – сильное основание (щелочь), диссоциирует практически полностью в одну ступень, отщепляя обе гидроксогруппы, в уравнении диссоциации ставят знак равенства:
Sr(OH)2 = Sr2+ + 2 OH–
Для сильного электролита выражение константы диссоциации не составляют.
 Sn(OH)2 – амфотерный гидроксид, слабый электролит, диссоциирует ступенчато и обратимо (в уравнении ставят знак обратимости), амфотерный гидроксид также можно записать в форме кислоты H2SnO2, диссоциация ее также протекает по правилам слабых электролитов:
Sn(OH)2 – амфотерный гидроксид, слабый электролит, диссоциирует ступенчато и обратимо (в уравнении ставят знак обратимости), амфотерный гидроксид также можно записать в форме кислоты H2SnO2, диссоциация ее также протекает по правилам слабых электролитов:
Sn(OH)2  SnOH+ + OH– по типу основания
SnOH+ + OH– по типу основания
SnOH+  Sn2+ + OH–
Sn2+ + OH–
 H2SnO2
H2SnO2  H+ + HSnO2– по типу кислоты
H+ + HSnO2– по типу кислоты
HSnO2–  H+ + SnO22–.
H+ + SnO22–.
Для каждой реакции составляют выражение константы диссоциации.
Na2SO4 – соль, сильный электролит как и все соли, диссоциирует практически полностью в одну ступень, в уравнении диссоциации ставят знак равенства:
Na2SO4 = 2 Na+ + SO42–
Ca(HCO3)2 – кислая соль, как и все соли – сильный электролит, в уравнении диссоциации по первой ступени ставят знак равенства:
Ca(HCO3)2 = Ca2+ + 2 HCO3–
Ион HCO3– является остатком слабой кислоты, диссоциирует по правилам слабых электролитов (коэффициент 2 из предыдущего уравнения брать не следует – достаточно показать диссоциацию одного иона):
HCO3–  H+ + CO32–
H+ + CO32–
(CuOH)2SO4 – основная соль, как и все соли – сильный электролит, в уравнении диссоциации по первой ступени ставят знак равенства:
(CuOH)2SO4 = 2 CuOH+ + SO42–
Ион CuOH+ является остатком слабого основания, диссоциирует по правилам слабых электролитов (коэффициент 2 из предыдущего уравнения брать не следует – достаточно показать диссоциацию одного иона):
CuOH+  Cu2+ + OH–.
Cu2+ + OH–.
Пример 2. Напишите уравнения реакций в молекулярной и ионной формах для следующих превращений:
NiO ® NiSO4 ® Ni(NO3)2 ® NiOHNO3
При написании ионных уравнений реакций на ионы расписывают только сильные растворимые электролиты.
NiO + H2SO4 = NiSO4 + H2O
NiO – оксид, неэлектролит, не способен распадаться на ионы, не расписывают на ионы;
H2SO4 – кислота сильный растворимый электролит, записывают в диссоциированном виде;
NiSO4 – растворимая соль, сильный электролит, записывают в диссоциированном виде;
H2O – слабый электролит, не расписывают на ионы;
NiO + 2H+ + SO42– = Ni2+ + SO42– + H2O
NiO + 2H+ = Ni2+ + H2O
NiSO4 + Ba(NO3)2 = BaSO4↓ + Ni(NO3)2
NiSO4 – растворимая соль, сильный электролит, записывают в диссоциированном виде;
Ba(NO3)2 – растворимая соль, сильный электролит, записывают в диссоциированном виде;
BaSO4 – нерастворимая соль, сильный электролит, не расписывают на ионы;
Ni(NO3)2 – растворимая соль, сильный электролит, записывают в диссоциированном виде;
Ni2+ +SO42– + Ba2+ +2 NO3– = BaSO4↓ + Ni2+ + 2 NO3–
SO42– + Ba2+ = BaSO4↓
Ni(NO3)2 + NaOH = NiOHNO3↓ + NaNO3
NiSO4 – средняя соль, растворимая, сильный электролит, записывают в диссоциированном виде;
NaOH – растворимое основание, щелочь, записывают в диссоциированном виде;
NiOHNO3 – основная соль, сильный электролит, нерастворима (как и большинство основных солей), не расписывают на ионы;
NaNO3 – растворимая соль, сильный электролит, записывают в диссоциированном виде;
Ni2+ + 2 NO3– + Na+ + OH– = NiOHNO3↓ + Na+ + NO3–
Ni2+ + NO3– + OH– = NiOHNO3↓
Na3PO4 ® H3PO4 ® Na2HPO4
Na3PO4 + 3HCl = H3PO4 + 3 NaCl
Na3PO4 – средняя соль, растворимая, сильный электролит, записывают в диссоциированном виде;
HCl – кислота сильный растворимый электролит, записывают в диссоциированном виде;
H3PO4 – кислота слабый электролит, растворимая, не расписывают на ионы;
NaCl – средняя соль, растворимая, сильный электролит, записывают в диссоциированном виде;
3 Na+ + PO43– + 3 H+ + 3Cl– = H3PO4 + 3 Na+ + 3Cl–
PO43– + 3 H+ = H3PO4
H3PO4 + 2 NaOH = Na2HPO4 + 2H2O
H3PO4 – кислота слабый электролит, растворимая, не расписывают на ионы;
NaOH – щелочь, сильный электролит, записывают в диссоциированном виде;
Na2HPO4 – кислая соль сильный электролит, растворима как и все кислые соли, следует расписать на ионы, но только по первой ступени;
H2O вода, слабый электролит, не расписывают на ионы;
H3PO4 + 2 Na+ + 2 OH– = 2 Na+ + HPO42– + 2H2O
H3PO4 + 2 OH– = HPO42– + 2H2O.
Пример 3. По заданному ионному уравнению напишите соответствующее молекулярное уравнение: Ni2+ + S2– = NiS.
При решении данного задания следует подобрать соединения так, чтобы ионам в предложенном сокращенном уравнении соответствовали сильные растворимые электролиты – растворимые соли, сильные кислоты или основания.
Ni(NO3)2 + Na2S = NiS + 2 NaNO3
Составим полное и затем сокращенное ионное уравнение, если оно совпадет с заданным, то задание выполнено корректно:
Ni2+ + 2 NO3– + 2 Na+ + S2– = NiS + 2 Na+ + 2 NO3–
Ni2+ + S2– = NiS.
Если в сокращенном ионном уравнении даны три частицы, то следует составить из двух формулу сильного растворимого электролита:
Cu2+ + OH–+ Cl– = CuOHCl
CuCl2 + NaOH = CuOHCl + NaCl
Cu2+ + 2Cl– + Na+ + OH– = CuOHCl + Na+ + Cl–
Cu2+ + OH–+ Cl– = CuOHCl.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 14796; Нарушение авторских прав?; Мы поможем в написании вашей работы!