
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения заданий. Пример 1. Рассчитайте концентрацию ионов H+, OH– и рН в растворе NaOH с концентрацией 0,1 моль/л
|
|
|
|
Пример 1. Рассчитайте концентрацию ионов H+, OH– и рН в растворе NaOH с концентрацией 0,1 моль/л.
Составим уравнение диссоциации NaOH:
NaOH = Na+ + OH–
Из уравнения видно, что при диссоциации 1 моль NaOH в растворе появляется 1 моль ионов OH–, следовательно, если в 1 литре раствора содержится 0,1 моль NaOH, тогда концентрация OH– в этом растворе также будет равна 0,1 моль/л.
[OH–] = 0,1 моль/л
Из уравнения ионного произведения воды рассчитывают концентрацию ионов H+:
КW = [H+][OH-] = 10-14.
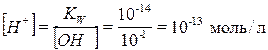
Рассчитывют рН раствора:
pH = – lg[H+] = – lg10–13 = 13
Пример 2. Напишите уравнения реакций гидролиза NiSO4, NaHCO3. Укажите область значений рН растворов (>, ≈, < 7).
При рассмотрении гидролиза солей следует помнить:
· гидролиз по катиону или по аниону – реакция обратимая (в уравнении ставят знак  );
);
· в растворе присутствует незначительное количество ионов H+ и OH-, возникших за счет диссоциации воды:
H2O  H+ + OH–
H+ + OH–
Уравнение реакции гидролиза NiSO4 (по первой ступени).
1. Уравнение диссоциации соли:
NiSO4 = Ni2+ + SO42–
2. Указывают катионом какого основания (сильного или слабого) и анионом какой кислоты (сильной или слабой) образована соль:
NiSO4 = Ni 2+ + SO42–
Ni(OH)2 H2SO4
(слаб.) (сильн.)
3. Гидролизу подвергается ион слабого электролита - Ni2+.
4. В ходе первой ступени гидролиза ион Ni2+ связывает из воды ион ОН- – ион противоположного заряда (только один), в результате образуется NiOH+. Оставшиеся от воды ионы H+ создают в растворе кислую среду рН < 7:
Ni2+ + HOH  NiOH+ + H+
NiOH+ + H+
5. Молекулярное уравнение:
в левой части записывают формулу соли (NiSO4), добавляют воду;
в правой части – правую часть краткого ионного уравнения:
NiSO4 + H2O NiOH+ + H+.
к каждой заряженной частице приписывают ион противоположного заряда (ион сильного электролита) – SO42–



 NiSO4 + H2O NiOH+SO42–+ H+SO42–
NiSO4 + H2O NiOH+SO42–+ H+SO42–
составляют формулы в соответствии с зарядами.
NiSO4 + H2O (NiOH)2SO4 + H2SO4
6. Расставляют коэффициенты.
2 NiSO4 + 2 H2O  (NiOH)2SO4 + H2SO4
(NiOH)2SO4 + H2SO4
Уравнение реакции гидролиза NaHCO3.
1. Уравнение диссоциации соли:
NaHCO3 = Na+ + HCO3–
2. Указывают катионом какого основания (сильного или слабого) и анионом какой кислоты (сильной или слабой) образована соль:
NaHCO3 = Na+ + HCO 3–
NaOH H2CO3
(сильн.) (слаб.)
3. Гидролизу подвергается ион слабого электролита – HCO3–.
4. В ходе гидролиза ион HCO3– связывает из воды ион H+ – ион противоположного заряда, в результате образуется H2CO3 – электронейтральная молекула. Оставшиеся от воды ионы OH– создают в растворе щелочную среду рН > 7:
HCO3– + HOH  H2CO3 + OH-
H2CO3 + OH-
5. Молекулярное уравнение:
в левой части записывают формулу соли (NaHCO3), добавляют воду;
в правой части – правую часть краткого ионного уравнения:
NaHCO3 + H2O H2CO3 + OH–.
к каждой заряженной частице приписывают ион противоположного заряда (ион сильного электролита) – Na+; к H2CO3 противоион не приписывают (электронейтральная частица).
NaHCO3 + H2O H2CO3 + Na+OH-
проверяют правильность формул в соответствии с зарядами.
NaHCO3 + H2O  H2CO3 + NaOH
H2CO3 + NaOH
6. Коэффициенты в данном случае не требуются.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 5772; Нарушение авторских прав?; Мы поможем в написании вашей работы!