
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет фазовых равновесий углеводородных смесей
|
|
|
|
Так как экспериментальный способ изучения газоконденсатных характеристик, являющийся основным при исследовании фазовых превращений углеводородов, трудоемок и требует много времени (для этого используется сложная аппаратура высокого давления), большое внимание уделяется развитию расчетных методов оценки этих характеристик.
Вследствие большого многообразия состава газоконденсатных систем, отдельные составляющие которых кипят при широком диапазоне температур, создать аналитически строгие расчетные методы построения газоконденсатных характеристик чрезвычайно сложно. Поэтому для прогнозирования фазовых превращений углеводородов при проектировании разработки газоконденсатных и газонефтяных месторождений и процессов переработки газа и конденсата используются приближенные методы расчета.
Расчетные методы оценки фазового состояния углеводородов основаны на законе Дальтона—Рауля pyi = xiQi, (IV. 8)
где р - общее давление смеси; yi и xi —молярные концентрации (доли) компонентов в паровой и жидкой фазах; Qi — давление насыщенных паров компонентов смеси в чистом виде; руi — парциальное давление i-ro компонента в паровой фазе; xiQi -парциальное давление того же компонента в жидкой фазе.
Очевидно, что  ;
;  . Здесь n'i и n"i - число молей i-ro компонента соответственно в газовой и жидкой фазах; m — общее число компонентов.
. Здесь n'i и n"i - число молей i-ro компонента соответственно в газовой и жидкой фазах; m — общее число компонентов.
Из уравнения равновесия (IV.8) следует, что углеводороды между фазами двухфазной равновесной системы распределяются в соответствии с давлением паров углеводородов и их мольными концентрациями.
При нарушении равновесия в системе вследствие изменения температуры или давления начинается перераспределение углеводородов между фазами. Это происходит до тех пор, пока парциальные давления каждого компонента в газе и жидкости не сравняются.
Углеводороды, имеющие при данной температуре давление насыщенных паров большее, чем общее давление в системе, будут иметь и более высокую концентрацию в паровой фазе, чем в жидкой; и наоборот. Таков смысл уравнения (IV.8).
Используя закон Дальтона — Рауля, зная температуру и давление, при которых находится смесь, по концентрации компонента в одной фазе можно определить ее концентрацию в другой.
Действительно, пусть дан состав жидкой фазы x1+x2+...+xm=1, где x1, х2,..., хm - молярная концентрация соответствующих компонентов, доли единицы;
Пусть давление насыщенных паров компонентов при данной, температуре равно Q1, Q2,..., Qm. Давление паров такой смеси по закону Рауля
р=р1+р2+…+рm=x1Q1+ x2Q2+...+xmQm
или 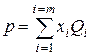 (IV.9)
(IV.9)
где p1, p2,..., рm — парциальное давление компонентов в жидкой фазе.
Уравнение (IV.9) называется уравнением начала однократного (контактного) испарения. Очевидно, что оно характеризует давление, когда кипит смесь при данной температуре (температура учитывается в уравнении (IV.9) в скрытом виде, так как она влияет на давление насыщенных паров компонентов Qi. Таким образом, при данном составе смеси р и t — давление и температура кипения (парообразования).
По закону Дальтона—Рауля при равновесии фаз для каждого компонента будет справедливо соотношение (IV.8), т. е. после определения давления паров жидкой смеси р можно определить концентрацию всех компонентов в равновесной паровой фазе по уравнению (IV.8):  . (IV.10)
. (IV.10)
Если же известен состав паровой фазы, то состав жидкости, находящейся в контакте с газом, можно также определить, используя закон Дальтона-Рауля.
Пусть дан состав паровой фазы смеси y1+y2+...+ym=1, где у1, y2, …, ym — молярная концентрация углеводородов в газовой фазе, доли единицы.
Определить общее давление в системе, как в предыдущем примере, нельзя, так как не известен состав жидкой фазы. Давление паров смеси по данным состава паровой фазы можно найти, исходя из следующего.
Для каждого компонента напишем y1p=x1Q1;  ;
;
y2p=x2Q2;  и т.д.. (IV.11).
и т.д.. (IV.11).
Суммируя концентрации компонентов в жидкой фазе, получим
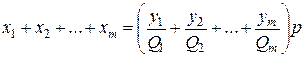 (IV-12)
(IV-12)
Отсюда, если известен состав паровой фазы, общее давление паров в смеси
 (IV-13)
(IV-13)
Определив по этой формуле давления паров смеси р, концентрацию компонентов в жидкой фазе можно найти из соотношения  (IV.14)
(IV.14)
Уравнение (IV.13) называют уравнением конца однократного испарения или уравнением начала однократной конденсации. Очевидно, что оно характеризует давление насыщенных паров углеводородной смеси при данной температуре.
Уравнения равновесия (IV.8), начала однократного испарения (IV.9) и начала конденсации (IV.13) описывают поведение лишь простых углеводородных смесей при низких давлениях, (0,4—0,5 МПа). В практических условиях (на промыслах) использовать их затруднительно, так как они не учитывают влияние давления и состава смеси на давление паров углеводородов, находящихся в смеси. Поэтому при практических расчетах используются константы фазовых равновесий или коэффициенты распределения.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1793; Нарушение авторских прав?; Мы поможем в написании вашей работы!