
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение констант фазового равновесия по давлению схождения
|
|
|
|
Метод определения констант фазового равновесия по давлению схождения -один из наиболее известных, получивших широкое распространение в инженерной практике как в нашей стране, так и за рубежом. Несмотря на то что этот метод эмпирический, его использование во многих случаях дает положительные результаты.
Метод основан на хорошо известном факте схождения констант равновесия компонентов легких парафиновых бинарных углеводородных смесей к единице при критическом давлении и данной температуре смеси. Константы равновесия многокомпонентных смесей сходятся к единице при критическом давлении только при критической температуре смеси. Как уже упоминалось, если температура смеси отличается от критической, давление, при котором константы равновесия сходятся к единице, не является реальным, так как многокомпонентная смесь переходит из двухфазного парожидкостного состояния в однофазное при давлении, меньшем давления схождения констант равновесия к единице. Константы равновесия имеют действительные физические значения лишь до давления перехода из двухфазного в однофазное состояние. Поэтому давление, при котором константы равновесия многокомпонентной смеси при температуре, отличной от критической, сходятся к единице, называется кажущимся давлением схождения.
Метод определения констант равновесия по давлению схождения основан на экспериментально проверенном Хенсоном и Брауком предположении о том, что константы равновесия компонентов, входящих в состав различных смесей, равны, если равны давления, температуры и давления схождения этих смесей.
Таким образом, константа равновесия компонента — функция давления, температуры и давления схождения, определяющего влияние фазовых составов системы на константы равновесия компонентов. Несмотря на то, что давление схождения есть функция компонентного состава обеих равновесных фаз, на практике принимают, что оно определяется или составом исходной смеси, или составом жидкой фазы при данном давлении.
Если известна молекулярная масса Мс7+ и плотность остатка rс7+, давление схождения рсх (в МПа) приближенно можно рассчитать по следующим формулам.
При 120£Мс7+rс7+£200 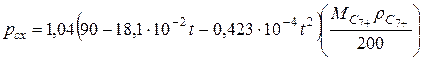 (IV.39) При 90£Мс7+rс7+<120
(IV.39) При 90£Мс7+rс7+<120 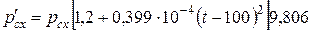 (IV.40)
(IV.40)
По известному составу жидкой фазы давление схождения (в МПа) можно определить по формуле 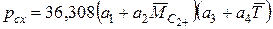 (IV.41)
(IV.41)
где 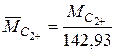 ;
;  ; a 1=0,12258886; a 2=1,225988; a 3=-0,12539303; a 4=1,1242308; Т - температура, К; MС2+ - средневзвешенная молекулярная масса гипотетического компонента этан плюс вышекипящие. Среднеквадратическая погрешность аппроксимации выражения рсх=f(MС2+, Т) составляет 0,103, коэффициент множественной корреляции равен 0,96.
; a 1=0,12258886; a 2=1,225988; a 3=-0,12539303; a 4=1,1242308; Т - температура, К; MС2+ - средневзвешенная молекулярная масса гипотетического компонента этан плюс вышекипящие. Среднеквадратическая погрешность аппроксимации выражения рсх=f(MС2+, Т) составляет 0,103, коэффициент множественной корреляции равен 0,96.
 ,
,  , (IV.42)
, (IV.42)
где Mi — молекулярная масса i-го компонента; gi — массовая доля i-ro компонента в псевдокомпоненте С2+.
Рассчитав каким-либо способом давление схождения смеси и задавшись значениями давления и температуры, константы фазового равновесия углеводородов и азота находят по таблицам констант равновесия СевКавНИИГаза [8] или по атласу констант Американской ассоциации газобензинового производства NGAA.
Константы равновесия углекислого газа и сероводорода можно определить следующим образом: КCО2 = (КСН4КС2Н6)1/2. (IV.43)
где КСН4, КС2Н6 определяются по атласу констант или по таблицам;
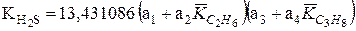 (IV.44)
(IV.44)
где  ;
;  ; a 1=0,0016766885; a 2=0,98823311; a 3=1,0331174; a 4=-0,8977×10-3.
; a 1=0,0016766885; a 2=0,98823311; a 3=1,0331174; a 4=-0,8977×10-3.
Константу равновесия остатка Kс7+ или КC8+ можно определить по формуле, зная молекулярную массу MC7+ или МС5+ и его относительную плотность rC7+ или rC5+: 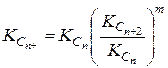 (IV.45)
(IV.45)
где при n³5 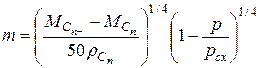
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2427; Нарушение авторских прав?; Мы поможем в написании вашей работы!