
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнения фазовых концентраций
|
|
|
|
Рассмотрим многокомпонентную смесь заданного состава в молярных долях (Shi=l), находящуюся в сосуде в двухфазном состоянии пар—жидкость при условиях термодинамического равновесия.
Масса смеси в сосуде остается постоянной, а давление смеси газов изменяется только за счет изменения объема этого сосуда. Температура смеси поддерживается постоянной.
Процесс изменения соотношения между фазами и переход компонентов смеси из одной фазы в другую при постоянных массе и составе смеси и изотермическом изменении давления называется контактной (однократной) конденсацией или контактным (однократным) испарением в зависимости от того, происходит ли конденсация компонентов из паровой фазы или испарение компонентов жидкой фазы при изменении давления.
Общее число молей исходной смеси N, находящейся в данной емкости, равно числу молей паровой Nп и жидкой Nж фаз при давлении р и температуре t, т. е.
N=Nп + Nж. (IV.32)
Число молей i-ro компонента распределяется между фазами следующим образом: hiN=уiNп + хiNж. (IV.33)
где hi, yi и xi — молярные доли i-ro компонента в исходной смеси, паровой и жидкой фазах соответственно.
Разделим левую и правую части равенства (IV.33) на N, т. е. напишем уравнение материального баланса распределения компонента в смеси для одного моля смеси в сосуде:  (IV.34)
(IV.34)
где V=Nп/N, L = Nж/N - молярные доли паровой и жидкой фаз в сосуде (V+L=1).
Подставляя в уравнение (IV.34) вместо yi = Kixi L=1—V, получим
 , (IV.35)
, (IV.35)
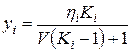 , (IV.36)
, (IV.36)
Замыкающие соотношения для составов смеси, паровой и жидкой фаз имеют вид Shi=1; Syi=1 и Sxi=1. (IV.37)
Равенство (IV.35) с учетом (IV.37) принимает вид
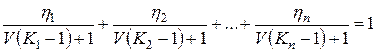 (IV.38)
(IV.38)
Решение уравнения (IV.38) методом последовательных приближений (итераций) позволяет найти такое значение V, при котором сумма дробей в левой части равенства равна единице. Для нахождения искомого значения V можно использовать метод Ньютона, метод хорд или метод деления отрезка пополам.
Уравнения (IV.35) и (IV.36) называются уравнениями фазовых концентраций компонентов смеси. Они позволяют определять концентрацию компонентов в фазах при определенных значениях Shi и заданных давлении, температуре, исходном составе смеси и константах фазовых равновесий.
Эти уравнения — фундаментальные уравнения прикладной термодинамики фазовых равновесий многокомпонентных смесей. На их основе проводится расчет парожидкостного равновесия природных нефтяных и газоконденсатных смесей и  аналитических методов их исследования [24].
аналитических методов их исследования [24].
Исследуем уравнение фазовых концентраций. Для этого построим зависимость Sxi от молярной доли жидкой фазы L (рис. IV.19).
Рис. IV.19. Зависимость Sxi от молярной доли L жидкой фазы 1, 2 — для случаев, когда жидкая фаза отсутствует; 3 — для случая, когда есть жидкая фаза (L= L1)
Из рис. IV. 19 следует, что если при L = 0

то жидкая фаза в смеси отсутствует, смесь находится в однофазном газообразном состоянии.
В том случае, когда Sxi>1 при L = 0, жидкая фаза имеется (L = L1). Если Sxi=l при L=1, вся смесь находится в однофазном жидком состоянии.
По уравнению  (L==0) определяется кривая начала образования жидкой фазы или кривая течек росы.
(L==0) определяется кривая начала образования жидкой фазы или кривая течек росы.
По уравнению  (V=0) определяется кривая начала образования паровой фазы из жидкой или кривая точек кипения.
(V=0) определяется кривая начала образования паровой фазы из жидкой или кривая точек кипения.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1624; Нарушение авторских прав?; Мы поможем в написании вашей работы!