
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константы фазовых равновесий
|
|
|
|
Константой фазового равновесия или коэффициентом распределения i-го компонента в паровую и жидкую фазы Ki называется отношение молярной доли i-ro компонента в паровой фазе уi к молярной доле его в жидкой фазе хi
Ki=yi/xi. (IV. 15)
Термин «коэффициент распределения» не получил широкого распространения для расчета фазового равновесия многокомпонентных смесей. Более распространен термин «константа фазового равновесия». Последний термин нельзя признать точным, поскольку отношение yi/xi действительно постоянное при фиксированных значениях давления и температуры лишь для идеальных растворов, т. е. когда это отношение не зависит от состава сосуществующих фаз. В таком случае константы равновесия называются идеальными константами.
Константа равновесия определяется двумя методами: 1) экспериментальным; 2) расчетным. Экспериментальный метод заключается в следующем. В сосуд высокого давления установки помещается исходная газоконденсатная смесь. Затем в сосуде создаются определенные давление и температура, условия термодинамического равновесия фаз. При постоянных давлении и температуре в сосуде в специальные пробоотборники отбираются пробы паровой и жидкой фаз.
На хроматографе или другом приборе определяют компонентные составы паровой и жидкой фаз в объемных (молярных долях) процентах. Делят молярные доли компонентов в паровой фазе на молярные доли этих же компонентов в жидкой фазе и получают таким образом константы фазовых равновесий компонентов при заданных давлении и температуре. Изменяют давления и температуры, получают константы равновесия для других давлений и температур.
 На рис. IV. 18 приведены экспериментальные константы равновесия углеводородов, входящих в состав нефтей с малой усадкой. Из этого рисунка видно, что каждый компонент имеет два значения давления, при которых константы равновесия равны единице: при давлении насыщенных паров компонентов (Q = p) и в точке их схождения к единице справа. Давление, соответствующее давлению в этой точке, называется давлением схождения. Если диаграмма составлена при критической температуре смеси, то давление схождения будет критическим. При других температурах это давление будет лишь кажущимся. По данным Катца, кажущееся давление схождения, при котором константы равновесия всех компонентов многих нефтей становятся одинаковыми и равными единице, составляет 35—34,5 МПа.
На рис. IV. 18 приведены экспериментальные константы равновесия углеводородов, входящих в состав нефтей с малой усадкой. Из этого рисунка видно, что каждый компонент имеет два значения давления, при которых константы равновесия равны единице: при давлении насыщенных паров компонентов (Q = p) и в точке их схождения к единице справа. Давление, соответствующее давлению в этой точке, называется давлением схождения. Если диаграмма составлена при критической температуре смеси, то давление схождения будет критическим. При других температурах это давление будет лишь кажущимся. По данным Катца, кажущееся давление схождения, при котором константы равновесия всех компонентов многих нефтей становятся одинаковыми и равными единице, составляет 35—34,5 МПа.
Рис, IV.18. Константы равновесия при t=93,3 °С для нефтей с низкой усадкой 1 - метан; 2 - этан; 3 - пропан; 4 — бутаны; 5 - пентаны; 6 - гексаны; 7 - гептаны+высшие
При низких давлениях и температурах константы равновесия углеводородов мало зависят от состава смеси. При высоких давлениях они могут быть найдены экстраполяцией их действительных значений, если известно давление схождения, значение которого определяется составом смеси.
Константу фазового равновесия метана приближенно можно рассчитать по следующей формуле. При 30£t£2600С
 (IV.16)
(IV.16)
где pCX —давление схождения, МПа.
Экспериментально определить константы равновесия весьма сложно, при этом требуются большие затраты времени. Полученные значения констант равновесия можно использовать в расчетах парожидкостного равновесия только данной системы, использованной в экспериментах. При исследованиях в бомбе высокого давления без пористой среды не учитываются влияния на константы равновесия поверхностных сил пористой среды, капиллярных сил, образования твердой фазы из раствора. Константы равновесия, определенные экспериментально, нельзя использовать для другого состава исходной смеси. Следовательно, при эксплуатации газоконденсатных или нефтяных месторождений, когда состав продукции скважин изменяется непрерывно, необходимо было бы проводить эксперименты для определения констант равновесия тоже непрерывно, что практически выполнить невозможно.
Расчетный метод состоит в использовании уравнений состояния реальных газов для определения летучестей компонентов смеси в паровой и жидкой фазах и далее — нахождении константы равновесия как отношения летучести компонента в паровой фазе и его летучести в жидкой фазе. Понятие летучести в практику расчетов парожидкостного равновесия было введено Льюисом. Он предложил сохранить форму уравнения для химического потенциала i-ro компонента смеси идеальных газов ji(p, Т) =ji.ид(T)+ RT ln pi (IV.17)
но использовать это уравнение для вычисления химического потенциала реальных газов, заменив давление pi на некоторую, функцию fi, зависящую от давления и названную им летучестью: ji(p,T) = ji.ид(T) + RT ln fi. (IV.18)
С физической точки зрения летучесть есть «исправленная» упругость насыщенных паров компонентов идеальных растворов или «исправленное» парциальное давление компонентов идеальных газовых смесей.
Летучесть f— «исправленное» давление, после подстановки значения которого в уравнения идеальных газов или растворов они становятся пригодными для описания свойств реальных газов и растворов.
В этом случае летучесть при различных давлениях и температурах должна определяться экспериментально для каждого реального газа.
Для идеального однокомпонентного газа летучесть f равна общему давлению, р, для компонентов смеси идеальных газов — парциальному давлению компонента, т. е. fi = yip.
Коэффициент сжимаемости z и летучесть f связаны соотношением
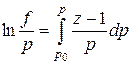 (IV.19)
(IV.19)
или, приближенно, летучесть равна произведению коэффициента сверхсжимаемости z на общее давление р, т. е. f»zp. (IV.20)
При термодинамическом равновесии паровой и жидкой фаз имеем равенство давлений, температур и химических потенциалов компонентов в фазах.
При равенстве фазовых давлений и температур химические потенциалы компонентов равны численно летучестям компонентов смеси в фазах.
Летучесть i-го компонента в равновесных паровой и жидкой фазах многокомпонентной смеси определяется следующими уравнениями:
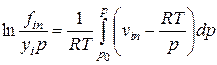 (IV-21)
(IV-21)
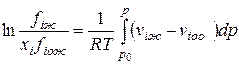 (IV-21)
(IV-21)
В этих формулах fin, fiж — летучести компонентов в паровой и жидкой фазах; р — общее давление смеси газов; fioж — летучесть чистого компонента при температуре смеси; viп, viж — молярные объемы i-го компонента в паровой и жидкой фазах; vioж — молярный объем i-ro компонента в чистом виде при давлении р и температуре Т.
Отношение fin к yip в термодинамике фазовых превращений получило название коэффициента летучести yi, а отношение fiж и xifioж — коэффициента активности gi: yi =fin / yip, gi = fiж / xifioж. (IV.23)
При термодинамическом равновесии между фазами fin=fiж, тогда
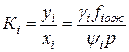 (IV.24)
(IV.24)
Константу равновесия можно определить еще и таким образом:
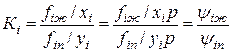 (IV.25)
(IV.25)
Отношение 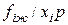 называется коэффициентом летучести компонента i в жидкой фазе. Подставляя уравнение состояния Пенга-Робинсона (III.68) в выражение (IV.21), получим расчетное уравнение для определения коэффициента летучести компонентов в газовой смеси
называется коэффициентом летучести компонента i в жидкой фазе. Подставляя уравнение состояния Пенга-Робинсона (III.68) в выражение (IV.21), получим расчетное уравнение для определения коэффициента летучести компонентов в газовой смеси
 (IV.26)
(IV.26)
где zсм– коэффициент сверхсжимаемости смеси, определяемый из уравнения (IV.27),
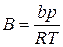 ,
, 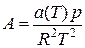 ,
,  (IV.27)
(IV.27)
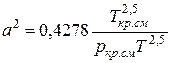 ;
; 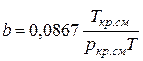 (IV.28)
(IV.28)
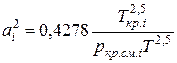 ;
; 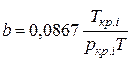 (IV.29)
(IV.29)
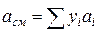 ;
; 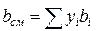 (IV.30)
(IV.30)
Зная состав равновесной жидкой фазы (Sхi=1), можно определить новые значения а см и bсм по формулам 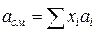 ;
; 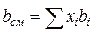 (IV.31)
(IV.31)
коэффициент сверхсжимаемости zсм жидкой фазы и, наконец, коэффициенты летучести компонентов жидкой фазы.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 8028; Нарушение авторских прав?; Мы поможем в написании вашей работы!