
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 1. Давление пара воды при 25 0С равно 3167,7 Па
|
|
|
|
Давление пара воды при 25 0С равно 3167,7 Па. Вычислите давление пара водного раствора, содержащего 18 г мочевины CO(NH2)2 в 360 г воды.
Решение: Согласно условию задачи Р 0=3167,7 Па. Найдём мольные доли растворённого вещества (CO(NH2)2) и растворителя (H2O) в растворе:
М(CO(NH2)2)=60 г/моль, М(H2O)=18 г/моль.
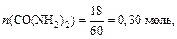
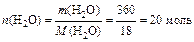 .
.
Подставим в уравнение закона Рауля имеющиеся данные:
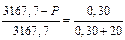 , отсюда Р = 3167,7 – 46,8=3120,9 Па.
, отсюда Р = 3167,7 – 46,8=3120,9 Па.
Ответ: 3120,9 Па
Пример 2. Какова массовая доля глицерина в растворе, если он замерзает при -0,52 0С?
Решение: Найдем понижение температуры замерзания раствора:
Δ t зам= t зам р-ра – t зам р-ля=0-(-0,52)= –0,52 0С
По закону Рауля: Δ t зам= К · m, К (H2O)=1,86 град.·моль-1·кг,
 .
.
Исходя из моляльности раствора, в 1000 г воды растворено 0,28 моль C3H5(OH)3. Найдем массу глицерина в растворе и массу раствора:
М (C3H5(OH)3)=92 г/моль; m (C3H5(OH)3)= М · n =92·0,28=25,76 г;
m р-ра= m (H2O)+ m (C3H5(OH)3)=1000+25,76=1025,76 г.
Вычислим массовую долю глицерина C3H5(OH)3 в растворе:
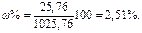 Ответ: 2,51%.
Ответ: 2,51%.
Пример 3. Определить эбулиоскопическую константу уксусной кислоты по следующим экспериментальным данным: уксусная кислота взята массой 250 г и в ней растворено 17,6 г вещества-неэлектролита, имеющего молярную массу 178 г/моль. Полученный раствор кипит на 1 0С выше, чем уксусная кислота.
Решение: Для нахождения эбулиоскопической константы используем уравнение закона Рауля: Δ t кип= Е · m.
Вычислим моляльность раствора:
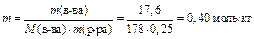
По условию задачи Δ t кип=1 0С, следовательно,
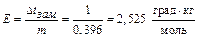 . Ответ: 2,52 град.∙кг∙моль-1.
. Ответ: 2,52 град.∙кг∙моль-1.
Пример 4. При 20 0С осмотическое давление раствора, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина, равно 243,4 кПа. Определите молекулярную формулу, если известен элементарный состав (в % мас.) гематина: С – 64,6; Н – 5,2; N – 8,8; О – 12,6; Fe – 8,8.
Решение: Из уравнения Р осм= С М RT найдем молярную концентрацию раствора:
243,4= С М·8,314·293, отсюда С М=243,4/(8,314·293)=0,10 моль/л.
Теперь вычислим молекулярную массу гематина. Из условия задачи следует, что в 1 л раствора содержится 63,3 г гематина, что составляет 0,1 моль. Таким образом, молярная масса гематина равна 63,3/0,1=633 г/моль, а молекулярная масса – 633.
Найдём простейшую формулу гематина. Обозначив числа атомов C, H, O, N, Fe через x, y, z, m, n, можем записать:
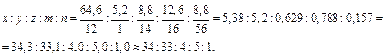
Следовательно, простейшая формула гематина С34H33N4O5Fe. Этой формуле соответствует молекулярная масса 633 (так как 34·12+33·1+4·14+5·16+56·1 = 633), что совпадает с найденным выше значением. Таким образом, молекулярная формула гематина такая же, как и простейшая С34H33N4O5Fe. Ответ: С34H33N4O5Fe.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 4587; Нарушение авторских прав?; Мы поможем в написании вашей работы!