
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации раствора
|
|
|
|
Содержание растворённого вещества в растворе может быть выражено либо безразмерными величинами – долями или процентами, либо величинами размерными – концентрациями. Наибольшее применение находят следующие способы выражения содержания растворённого вещества в растворе:
1) Массовая доля (ω) – отношение массы вещества, содержащегося в растворе, к общей массе раствора. Это отношение может быть выражено в долях единицы или в процентах:

2) Мольная доля (N i) – отношение количества растворённого вещества (n 2) или растворителя (n 1) к сумме количеств всех веществ, находящихся в растворе. В растворе, состоящем из растворителя и единственного растворённого вещества, мольная доля вещества (N 2) равна:

 .
.
3) Молярная концентрация (С М или М) – отношение количества растворённого вещества к объему раствора (V):
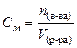
4) Молярная концентрация эквивалента (эквивалентная концентрация или нормальность) (С н или н.) – отношение количества эквивалентов растворённого вещества к объему раствора:

5) Моляльность (m) – отношение количества растворенного вещества к массе растворителя:

Пример 1. Рассчитайте молярную концентрацию эквивалента, моляльность и массовую долю (в %) серной кислоты в 2 моль/л растворе H2SO4 , имеющем плотность 1,12 г/мл.
Решение:
а) М (H2SO4) = 98 г/моль. Молярная масса эквивалента H2SO4 в реакциях полной нейтрализации равна: М экв(H2SO4) = 98/2 = 49 г/моль.
Отношение М (H2SO4)/ М экв(H2SO4) = 98/49 = 2. Следовательно, 1 моль/л раствор содержит 2 (моль-эквивалентов)/л H2SO4, а 2 моль/л раствор – 4 (моль-эквивалентов)/л, т.е. является четырехнормальным (4 н.).
б) Для вычисления моляльности найдем массу одного литра 2 моль/л раствора, массу вещества (H2SO4) и растворителя (H2O) в нём:
m р-ра= r V р-ра=1,12·1000=1120 г,
m в-ва= М (H2SO4)· n (H2SO4)=98·2=196 г,
m р-ля= m р-ра - m в-ва=1120-196=924г=0,924 кг,
n (H2SO4) в 1 л раствора – 2 моль.
Моляльность раствора равна:
m = n (H2SO4)/ m р-ля=2/0,924=2,16 моль/кг.
в) Массовая доля серной кислоты в 2моль/л растворе составляет:
ω %=(m в-ва/ m р-ра)·100=(196/1120)·100=17,55%.
Ответ: 4 н.; 2,16 моль/кг; 17,55%.
Пример 2. Сколько миллилитров 96%-ного (по массе) раствора H2SO4 с плотностью 1,84 г/см3 потребуется для приготовления 250 мл 0,5 моль/л раствора кислоты?
Решение: Найдем массу кислоты в 250 мл (или 0,250 л) 0,5 моль/л раствора:
М (H2SO4)=98 г/моль.
m (H2SO4)= М( H2SO4)· n (H2SO4)·98·0,5·0,250=12,25 г.
Масса 96%-ного раствора H2SO4, содержащего 12,25 г кислоты, равна:
m р-ра= m (H2SO4)·100/ ω =12,25·100/96=12,76 г.
Объём 96%-ного раствора H2SO4, который потребуется для приготовления 250 мл 0,5 моль/л раствора, составит:
V р-ра= m р-ра/ r =12,76/1,84=6,93 мл. Ответ: 6,93 мл.
Пример 3. Сколько граммов медного купороса CuSO4·5H2O нужно взять для приготовления 5 л 8%-ного (по массе) раствора безводной соли CuSO4, плотность которого 1,084 г/см3?
Решение: Найдем массу 5 л 8%-ного раствора плотностью 1,084 г/см3 и массу и количество (в моль) безводной соли в нем:
m р-ра= r V р-ра=1,084·5000=5420 г,
m (CuSO4)= m р-ра∙ ω /100=5420·8/100=433,6 г
М (CuSO4)=160 г/моль, n (CuSO4)= 433,6/160=2,71 моль.
Так как 1 моль CuSO4·5H2O содержит 1 моль CuSO4, то количество кристаллогидрата, необходимое для приготовления раствора, будет равно 2,71 моль. Вычислим массу кристаллогидрата:
М (CuSO4·5H2O)=250 г/моль,
m (CuSO4·5H2O)=250·2,71=677,5 г. Ответ: 677,5 г.
Пример 4. Какой объем 5%-ного раствора KOH, плотность которого 1,04 г/мл, требуется для реакции с 20 мл 10 %-ного раствора FeCl3, плотность которого 1,087 г/мл?
Решение: Найдем массу и количество (в моль) FeCl3, содержащегося в 20 мл 10 %-ного раствора:
m (FeCl3)= r V р-ра· ω /100=1,087·0,020·10/100=2,174 г.
М (FeCl3)=162,2 г/моль, n (FeCl3)=2,174/162,2=0,0134 моль.
Вычислим массу KOH, которая требуется для взаимодействия с FeCl3. По уравнению реакции:
3KOH + FeCl3 = Fe(OH)3 + 3KCl
1 моль FeCl3 взаимодействует с 3 моль KOH,
а 0,0134 моль FeCl3 – 0,0134·3=0,0402 моль.
М (KOH)=56 г/моль, m (KOH)=56·0,0402=2,25 г.
m р-ра(KOH)=2,25·100/5=45 г.
По плотности раствора KOH находим объём раствора:
V р-ра= m р-ра/ r =45/1,04=43,26 мл. Ответ: 43,26 мл.
Задачи для самостоятельного решения
101. Определите объем 98%-ного раствора серной кислоты H2SO4 (r=1,84 г/см3), необходимый для приготовления 500 мл раствора с молярной концентрацией эквивалента (по реакции полной нейтрализации) 0,5 моль/л. (Ответ: 6,79 мл)
102. До какого объема нужно разбавить 500 мл 20 %-ного (по массе) раствора NaCl (r = 1,152 г/см3), чтобы получить 4,5 %-ный раствор (r = 1,029 г/см3)? (Ответ: 2,49 л)
103. К 500 мл 32 %-ного (по массе) раствора HNO3 (r = 1,20 г/см3) прибавили 1 л воды. Определите массовую долю азотной кислоты в полученном растворе. (Ответ: 12%)
104. Сколько граммов глауберовой соли Na2SO4×10H2O нужно растворить в 500 г воды для получения 5%-ного раствора безводной соли? (Ответ: 59,67 г)
105. Чему равна молярная концентрация эквивалента в растворе, полученном прибавлением 3,8 л воды к 200 мл раствора NaOH с молярной концентрацией эквивалента 1 моль/л.
(Ответ: 0,05 моль/л)
106. Сколько литров 2,5%-ного раствора KOH (r=1,03 г/см3) можно приготовить из 80 мл 35%-ного раствора (r=1,38 г/см3)?
(Ответ: 1,5 л)
107. Вычислите молярную концентрацию и моляльность 40%-ного раствора фосфорной кислоты H3PO4 плотностью 1,25 г/см3.
(Ответ: 5,1 моль/л, 6,8 моль/кг)
108. Вычислите молярную концентрацию эквивалента и моляльность 21%-ного раствора HNO3 плотностью 1,12 г/см3.
(Ответ: 3,73 моль/л, 4,21 моль/кг)
109. Чему равна молярная концентрация и моляльность раствора H2SO4, полученного смешением 950 г воды и 50 мл 48%-ного раствора H2SO4 плотностью 1,38 г/см3?
(Ответ: 0,338 моль/л; 0,343 моль/кг)
110. На полную нейтрализацию 50 мл раствора серной кислоты с молярной концентрацией эквивалента 0,5 моль/л пошло 25 мл раствора едкого натра. Сколько граммов NaOH содержит 1 л этого раствора?
(Ответ: 40 г)
111. Для осаждения всего хлора, содержащегося в 15 мл раствора NaCl, израсходовано 25 мл раствора AgNO3 с молярной концентрацией эквивалента 0,1 моль/л. Сколько граммов NaCl содержит 1 л этого раствора? (Ответ: 9,75 г)
112. Какой объем 70%-ного раствора H2SO4 (плотностью 1,622 г/см3) требуется для приготовления 25 мл раствора с концентрацией 2 моль/л? (Ответ: 4,32 мл)
113. Какое количество раствора гидроксида калия с молярной концентрацией эквивалента 0,1 моль/л необходимо для полной нейтрализации 10 мл 20%-ного раствора серной кислоты плотностью 1,143 г/см3? (Ответ: 466,5 мл)
114. Вычислите молярную концентрацию раствора сульфата калия, в 20 мл которого содержится 1,74 г растворенного вещества. Какова нормальная концентрация этого раствора по отношению к реакциям полного обмена? (Ответ: 0,5 М; 1 н.)
115. Из 900 г раствора 50%-ной серной кислоты, выпариванием удалили 200 г воды. Чему равна массовая доля кислоты в оставшемся растворе? (Ответ: 64,3%)
116. Какой объем 10%-ного раствора хлорида бария, плотность которого 1,09 г/мл, требуется для реакции с сульфатом натрия, содержащемся в 20,0 мл 10%-ного раствора Na2SO4, плотность которого 1,14 г/мл? (Ответ: 28,8 мл)
117. Сколько граммов углекислого кальция выпадает в осадок, если к 400 мл 0,25 моль/л раствора хлористого кальция прибавить избыток раствора соды? (Ответ: 10 г)
118. На нейтрализацию 20 мл раствора, содержащего 12 г щелочи, было израсходовано 24 мл раствора кислоты с молярной концентрацией эквивалента 0,25 моль/л. Рассчитайте молярную массу эквивалента щелочи. (Ответ: 40г/моль)
119. Сколько мл раствора щелочи с молярной концентрацией 2 моль/л потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 мл 0,3 моль/л раствора FeCl3?
(Ответ: 450 мл)
120. Какой объем 10%-ного раствора серной кислоты с плотностью 1,07 г/см3 потребуется для нейтрализации раствора, содержащего 16 г NaOH? (Ответ: 183,2 мл)
Раздел 7
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2857; Нарушение авторских прав?; Мы поможем в написании вашей работы!