
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи для самостоятельного решения. 121. Давление пара воды при 20 0С составляет 2338 Па
|
|
|
|
121. Давление пара воды при 20 0С составляет 2338 Па. Сколько граммов сахара C12H22O11 следует растворить в 720 г воды для получения раствора, давление пара которого на 18,7 Па меньше давления пара воды? (Ответ: 110,28 г)
122. При 315 К давление насыщенного пара над водой равно 8,2 кПа. На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы C6H12O6?
(Ответ: на 54,30 Па)
123. Давление пара чистой воды при 100 0С составляет 101325 Па, а давление пара раствора, полученного растворением 27 г глюкозы в 108 г воды, при той же температуре равно 98791,9 Па. Вычислите молекулярную массу глюкозы? (Ответ: 175,5 г/моль)
124. Каково давление пара при 100 0С раствора мочевины CO(NH2)2, в котором ее массовая доля составляет 10%. Давление пара воды при 100 0С равно 1,013×105 Па. (Ответ: 9,803×104 Па)
125. Давление водяного пара при 70 0C равно 31,68×103 Па. Найдите понижение давления пара раствора глюкозы, в котором ее массовая доля составляет 11,86%. (Ответ: 41,4 Па)
126. Для предотвращения замерзания в зимнее время к водным растворам добавляют глицерин C3H5(OH)3. Допустив, что закон Рауля применим к подобным растворам, вычислите, сколько глицерина нужно прибавить к 100 г воды, чтобы раствор не замерзал до –5 0С.
(Ответ: 24,75 г глицерина)
127. Имеется 10%-ный водный раствор метилового спирта CH3OH и 10%-ный раствор этилового спирта C2H5OH. Какой из этих растворов будет замерзать при более низкой температуре? Ответ подтвердите расчетом. (Ответ: раствор CH3OH)
128. При растворении 15 г хлороформа CHCl3 в 400 г диэтилового эфира (C2H5)2O температура кипения раствора повысилась на 0,665 0С. Определите молекулярную массу хлороформа.
(Ответ: 119,5 г/моль)
129. При растворении 3,24 г серы в 40 г бензола температура кипения раствора повысилась на 0,81 0С. Из скольки атомов состоит молекула серы? (Ответ: из 8)
130. Из скольки атомов состоит молекула йода в спиртовом растворе, если температура кипения этилового спирта, равная 78,3 0С, повышается до 78,59 0С при растворении йода массой 12,7 г в 200 г спирта?
(Ответ: из 2)
131. Раствор, содержащий 2,7 г фенола C6H5OH в 75 г бензола, замерзает при 3,5 0C, тогда как чистый бензол замерзает при 5,5 0C. Определите криоскопическую константу бензола.
(Ответ: 5,2 град.·кг/моль)
132. Раствор, приготовленный из 100 г ацетона и 2,3 г глицерина C3H5(OH)3, кипит при 56,73 0С. Вычислите эбулиоскопическую константу ацетона. (Ответ: 1,722 град.·кг/моль)
133. Вычислите массовую долю (в %) сахара C6H12O6 в его водном растворе, зная, что температура замерзания этого раствора равна –0,93 0С. (Ответ: 14,6%)
134. Вычислите массовую долю (в %) метанола CH3OH в его водном растворе, температура замерзания которого –2,79 0C.
(Ответ: 4,58%)
135. Осмотическое давление крови 760 кПа. Какова молярная концентрация глюкозы в растворе, изотоничном крови при 37 0C.
(Ответ: 0,295 моль/л)
136. Осмотическое давление раствора, в 250 мл которого содержится 0,66 г мочевины CO(NH2)2, равно 836 мм рт. ст. при 33 0C. Вычислите молекулярную массу мочевины.
(Ответ: 60,3 г/моль)
137. Раствор сахара C12H22O11 при 0 0C обнаруживает осмотическое давление равное 3,545 кПа. Сколько граммов сахара содержится в 1 л раствора? (Ответ: 53,4 г)
138. Каким (гипо-, гипер-, изотоническим) является 20%-ный раствор глюкозы плотностью 1,08 г/мл при 310 К, применяемый для внутривенного введения при отеке легких, если осмотическое давление плазмы крови 780 кПа? (Ответ: Росм. =3092,8 кПа)
139. К 100 мл водного раствора сахара C12H22O11 с молярной концентрацией 0,5 моль/л добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 0C?
(Ответ: 309,7 кПа)
140. Раствор, в 100 мл которого находится 2,30 г вещества-неэлектролита, обладает при 298 К осмотическим давлением 618,5 кПа. Определите молекулярную массу растворенного вещества.
(Ответ: 92,13 г/моль)
Раздел 8
Ионное произведение воды. Водородный показатель.
Произведение растворимости
Ионное произведение воды. Водородный показатель. В чистой воде некоторая, хотя и очень незначительная, часть молекул воды диссоциирована на ионы:
H2O ⇄ H+ + OH-.
Измерениями установлено, что при комнатной температуре (точнее при 25 0С) концентрация как водородных, так и гидроксид-ионов в чистой воде равна 10-7 моль/л:
[H+] = [OH-] = 10-7 моль/л.
Произведение концентраций водородных и гидроксид-ионов называется ионным произведением воды и численно равно 10-14. Ионное произведение воды есть величина постоянная не только для воды, но и для разбавленных водных растворов любых веществ. Обозначив эту величину как  , можно написать:
, можно написать:
 = [H+]×[OH-] = 10-14.
= [H+]×[OH-] = 10-14.
Следует помнить, что ионное произведение воды равно 10-14 только при 25 0С. С повышением температуры оно увеличивается, с понижением – уменьшается. Однако для расчетов, относящихся к комнатным температурам, можно во всех случаях принимать
 = 10-14.
= 10-14.
Растворы, в которых концентрация водородных и гидроксид-ионов одинакова и равна 10-7 моль/л, называются нейтральными растворами. В кислых растворах [H+] > [OH-], в щелочных, наоборот, [H+] < [OH-]. Но как бы не менялись концентрации [H+] и [OH-] ионов в растворе, произведение их концентраций остается постоянным, равным 10-14. Поэтому, зная концентрацию одного из ионов воды, легко рассчитать и концентрацию второго иона:
 ;
; 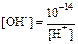 .
.
Таким образом, реакция любого водного раствора, т.е. степень его кислотности или щелочности, может быть количественно охарактеризована концентрацией только одного из ионов воды. Принято характеризовать ее концентрацией ионов водорода.
По многим соображениям оказалось удобнее вместо концентрации ионов водорода указывать взятый с обратным знаком десятичный логарифм концентрации ионов водорода. Эта величина называется pH или водородным показателем:
pH = – lg[H+].
Из всего сказанного следует, что:
1) в нейтральном растворе рН = 7;
2) степень кислотности раствора;
3) в щелочных растворах рН > 7.
Зная рН какого-либо раствора, нетрудно рассчитать, какова в нем концентрация [H+]- или [OH-] = ионов. Наоборот, по величине концентрации [H+]- или [OH-]-ионов можно установить рН раствора.
Пример 1. Концентрация ионов водорода в растворе равна 0,004 моль/л. Определите рН раствора.
Решение:
Зная, что pH = – lg[H+], получаем: pH = – lg0,004 = 2,4.
Ответ: 2,4.
Пример 2. Рассчитайте концентрацию ионов водорода и гидроксид - ионов в артериальной крови с рН = 7,42.
Решение:
Поскольку pH = – lg[H+], то
[H+] = 10-7,42 = 3,8×10-8 моль/л, а
[ОH-] = 10-14/3,8·10-8 = 2,63×10-7моль/л.
Концентрацию [ОH-]-ионов можно определить и другим способом:
рН + рОН = 14, отсюда рОН = 14 – рН = 14 – 7,42 = 6,558;
[ОH-] = 10-рОН = 10-6,58 =2,63×10-7 моль/л.
Ответ: 3,8×10-8 и 2,63×10-7 моль/л.
Произведение растворимости. В насыщенном растворе малорастворимого электролита, в кристаллах которого связи имеют преимущественно ионный характер, устанавливается динамическое равновесие между перешедшими в раствор ионами этого вещества и твердой фазой:
CaCO3 ⇄ Ca2+ + CO32-
твёрдая фаза раствор
В растворе вещество полностью диссоциировано, поэтому в его насыщенном растворе произведение концентраций ионов, образующих это вещество, является также постоянной величиной и называется произведением растворимости.
Произведение растворимости характеризуется постоянной при данной температуре величиной, равной произведению концентраций ионов (моль/л) малорастворимого электролита, возведённых в степень соответствующих стехиометрических коэффициентов. Произведение растворимостиобозначают сокращённо ПР.
Для бинарного электролита CaCO3: ПР = [Ca2+][CO32-], для трёхионного электролита CaF2: ПР = [Ca2+][F-]2.
В ненасыщенном растворе карбоната кальция, а также при растворении осадка CaCO3 произведение концентраций ионов Ca2+ и CO32- меньше величины произведения растворимости CaCO3:
[Ca2+][CO32-] < 
В пересыщенном растворе карбоната кальция, из которого начинается выпадение осадка CaCO3, произведение концентраций ионов Ca2+ и CO32- больше величины произведения растворимости CaCO3:
[Ca2+][CO32-] >  .
.
Если известна растворимость малорастворимого электролита, можно вычислить произведение растворимости этого вещества, и, наоборот, по величине ПР легко рассчитать растворимость вещества (в моль/л или г/л).
Пример 1. Растворимость хлорида серебра в воде при 25 0С равна 1,79 мг в 1 л раствора. Чему равна величина произведения растворимости AgCl при данной температуре?
Решение: Растворимость AgCl при 25 0С в моль/л будет равна:
m (AgCl) /М (AgCl): V р-ра = 1,79·10-3/143,34 = 1,25×10-5 моль/л.
Концентрация ионов Ag+ и Cl- в растворе одинакова:
[Ag+] = [Cl-] = 1,25×10-5 моль/л,
отсюда ПР AgCl = [Ag+]∙[Cl-] = (1,25×10-5)2 = 1,56·10-10.
Ответ: 1,56·10-10.
Пример 2. Произведение растворимости хлорида свинца в воде при 25 0С равно 2,24·10-4. Вычислите растворимость PbCl2, выраженную молярной и массовой концентрациями.
Решение:
Обозначим молярную растворимость PbCl2 S (моль/л). Так как диссоциация PbCl2 идет по уравнению:
PbCl2 ⇄ Pb2+ + 2Cl-,
то, следовательно, при полном распаде S (моль/л) PbCl2 в растворе образуют S (моль/л) ионов Pb2+ и 2 S (моль/л) ионов Cl-. Произведение растворимости для PbCl2 имеет следующий общий вид:
ПР = [Pb2+]∙[Cl-]2.
Заменив концентрации ионов соответствующими значениями, выраженными через S, получим:
ПР = [ S ][2 S ]2 = 4 S 3, отсюда 4 S 3 = 2,24∙10-4, S = 3,98·10-2.
Растворимость PbCl2, выраженная молярной концентрацией, равна 3,98·10-2 моль/л.
Вычислим растворимость PbCl2 в г/л:
М (PbCl2) = 278,1 г/моль, М ∙ S =278,1∙3,98∙10-2 = 10,58 г/л.
Ответ: 3,98·10-2 моль/л; 10,58 г/л.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3870; Нарушение авторских прав?; Мы поможем в написании вашей работы!