
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей 3 страница
|
|
|
|
[Al(OH)4(H2O)2]- +H+ +3H2O⇄А1(ОН)3+6Н2О⇄[Al(H2O)6]3+ +3OH-
Согласно принципу Ле Шателье это равновесие смещается в любую сторону прибавлением к раствору кислоты или основания. В первом случае образуются соли трехвалентного алюминия, а во втором – гидроксоалюминаты [А1(ОН)4(Н2О)2]-.
При нагревании на воздухе р -металлы IV группы: Ge, Sn, Pb взаимодействуют с кислородом, серой, галогенами. В соответствии с наиболее характерными степенями окисления германий и олово при взаимодействии с кислородом воздуха образуют высшие оксиды МеО2, а свинец – низший PbO. Oксиды GeO, SnO, PbO2 получают косвенным путем.
Оксид германия GeO при растворении в воде дает германиевую кислоту H2GeO2. Диоксид германия GeO2 растворяется в воде с образованием полимерных анионов, например, HGe5O11-. Эти растворы имеют кислую реакцию.
Оксиды SnO и PbO в воде нерастворимы, но, проявляя амфотерность, растворяются в кислотах и щелочах. Для растворения PbO следует применять азотную кислоту, так как Pb(NO3)2, в отличие от PbCl2 и PbSO4, растворим в воде. От SnO к PbO усиливается основный характер оксида и соответствующего ему гидроксида, поэтому эти соединения свинца растворяются лишь в концентрированных растворах щелочей. В общем виде реакцию можно представить так:
МеО + 2NaOH = Na2[Ме(ОН)4]
Диоксиды SnO2 и PbO2 не растворимы в воде. Они амфотерны. В мелкодисперсном состоянии медленно растворяются в растворах щелочей с образованием комплексных соединений состава Na2[Ме(ОН)6].
Все гидроксиды – типичные амфотерные соединения, поэтому растворяются как в кислотах, так и в сильных щелочах. В первом случае образуются соли с катионами Ме2+ и Ме4+, а во втором - анионы [Ме(ОH)4]2- или [Ме(ОH)6]2-:
[Ме(ОH)4]2- 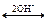 Ме(ОН)2
Ме(ОН)2  Ме2+ + 2H2O
Ме2+ + 2H2O
[Ме(ОH)6]2- 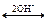 Ме(ОН)4
Ме(ОН)4  Ме4+ + 4H2O
Ме4+ + 4H2O
Так как для свинца более характерна степень окисления +2, соединения Pb(IV) являются сильными окислителями. Поэтому PbO2 используется в качестве окислителя.
Металлы V группы (Sb и Bi), относящиеся к р -элементам, при нагревании на воздухе сгорают с образованием оксидов состава Ме2О3. Оксид сурьмы (III) обладает амфотерными свойствами, а висмута (III) – преимущественно основными. При непосредственном взаимодействии Sb и Bi с кислородом высшие оксиды не образуются. Высший оксид получен только для сурьмы (косвенным путем), он проявляет кислотный характер. Влажный Sb2O5 окрашивает лакмус в красный цвет, при растворении его в щелочах образуются антимонаты: Na[Sb(ОН)6].
Задачи для самостоятельного решения
241. Чем отличается электролитический способ получения щелочных металлов от электролитического способа получения едких щелочей? Какие электролитические процессы происходят в том и другом случае?
242. Кислородные соединения щелочных металлов бывают следующих типов: М2О, М2О2, МО2, МО3 (М – щелочной металл). Как называются эти соединения? Напишите уравнения реакций взаимодействия их с водой. Какое практическое применение имеют пероксиды и озониды металлов?
243. Почему при кипячении воды с золой растений образуется сильнощелочной раствор, который называют ”щёлоком”? Какова биологическая роль натрия и калия?
244. При помощи каких реакций можно осуществить следующие превращения:
NaCl®Na®Na2O2®NaOH®Na2CO3®NaNO3®NaNO2?
245. В трех пробирках находятся вода, соляная кислота и раствор щелочи. В каждую пробирку бросили кусочек бериллия. Что будет наблюдаться, если вместо бериллия взять кусочек: а) магния, б) кальция? Запишите уравнения происходящих реакций.
246. Что представляют собой “извести”: негашёная, гашеная, хлорная, натронная? Каков их химический состав? Как они получаются? Приведите уравнения соответствующих реакций.
247. Присутствие каких солей в природной воде обусловливает ее жесткость? Что такое постоянная и временная жесткость? Напишите уравнения реакций устранения постоянной и временной жесткости воды. В каких единицах измеряется жесткость воды?
248. Как можно получить гидрид кальция? Какое практическое значение он имеет? Как отличаются гидриды щелочных и щелочноземельных металлов от водородных соединений неметаллов по характеру химической связи и физическим свойствам?
249. Какие соединения магния и кальция применяют в качестве вяжущих материалов в строительстве, в медицине? Чем обусловлены их вяжущие свойства? Как получают жжёный гипс? Приведите реакцию “схватывания” гипса.
250. Какие природные соединения используются в электролитическом процессе получения алюминия? Напишите уравнения катодного и анодного процессов.
251. Какое практическое значение имеет высокое сродство алюминия к кислороду? В чем заключается сущность процесса алюмотермии? Составьте электронные и молекулярные уравнения реакций, на которых основано применение термита.
252. Какое из веществ: NaOH или NH3×H2O следует взять для полного осаждения гидроксида алюминия? Ответ поясните. Напишите уравнения реакций получения гидроксида алюминия и его взаимодействия с хлороводородной кислотой и раствором едкого натра. Какими свойствами обладает гидроксид алюминия?
253. Чем определяется большая коррозионная стойкость алюминия? Как относится этот металл к кислотам и щелочам? Чем объясняется его пассивация в азотной кислоте и концентрированной серной кислоте на холоду?
254. Какая из степеней окисления является более устойчивой для германия, олова и свинца? Окислителями или восстановителями являются соединения олова(II) и свинца(IV)? Почему при растирании порошка PbO2 c серой или фосфором происходит воспламенение? В каком производстве это используется?
255. Можно ли металлический свинец отличить от германия и олова, пользуясь азотной кислотой? В какие соединения переходит свинец при действии азотной кислоты любых концентраций? Запишите уравнения соответствующих реакций.
256. В виде каких соединений находятся олово и свинец в природе? Каковы общие принципы получения этих металлов? Где они используются в технике?
257. Для свинца известны четыре кислородных соединения: PbO, Pb3O4, Pb2O3, PbO2. Как они называются? Какую степень окисления проявляет свинец в этих оксидах? Допишите следующие уравнения реакций и подберите коэффициенты:
Pb3O4 + HCl ®…
Pb3O4 + HNO3 ®…
258. Что является причиной уменьшения устойчивости соединений по ряду SnCl4, PbCl4, PbBr4, PbI4? Почему два последних соединения не выделены? Покажите, как взаимодействует PbO2 с соляной кислотой при охлаждении и в обычных условиях?
259. Какой из гидроксидов обладает более сильными основными свойствами: Sn(OH)2 или Pb(OH)2?. Какая из солей: Pb(NO3)2 или Sn(NO3)2 гидролизуется сильнее? Мотивируйте свой ответ.
260. Чем объясняется токсическое действие свинца? При отравлениях для вывода свинца из организма применяется раствор сульфата натрия (~10%). Каков принцип действия такого раствора?
Раздел 14
Химия d -металлов
Самый многочисленный класс металлов составляют d - и f -элементы. В периодической системе элементов Д. И. Менделеева они располагаются между s - и р -элементами, по этой причине их назвали переходными.
У атомов d -элементов происходит застройка d -орбиталей. Так как таких орбиталей пять, а на одной орбитали могут быть два электрона, то каждое семейство d -элементов состоит из десяти элементов. В четвертом и пятом периодах располагаются соответственно первый и второй ряды переходных элементов (3 d - и 4 d -металлы). В шестом и седьмом периодах помимо 6 d - и7 d -металлов располагаются по 14 f -металлов. В силу большой близости физических и химических свойств 4 f - и -5 f -металлы объединяют в отдельные семейства, называемые лантаноидами и актиноидами.
Вследствие сходства в строении внешних электронных оболочек атомов переходные элементы близки по свойствам. Однако эта близость относительна. Степень сходства и различия переходных металлов демонстрируется первым переходным рядом - 3 d - металлами.
Для большинства переходных d -металлов характерно несколько степеней окисления. Среди 3 d -металлов исключение составляют только скандий и цинк, у которых значения степени окисления постоянные (+3 и +2 соответственно). Наблюдаемая для каждого элемента переходного периода максимальная степень окисления с ростом порядкового номера сначала возрастает, а затем уменьшается. Например, максимальная степень окисления у скандия +3, у титана +4, у ванадия 4-5, у хрома +6 и у марганца +7. Это самая высокая степень окисления среди 3 d -переходных элементов. У элементов, следующих за марганцем, максимальные степени окисления равны +6 (железо), +4 (кобальт, никель), +3 (медь) и +2 (цинк). Однако она для всех этих элементов, кроме цинка, малохарактерна. Наиболее устойчивы состояния +2 и +3 - для железа, + 2 - для кобальта и никеля, +2 и +1 - для меди.
Способность проявлять ту или иную степень окисления определяется наличием d- и s -электронов с относительно низкой энергией ионизации. В ряду 3 d -элементов с увеличением порядкового номера наблюдается уменьшение ионных радиусов, что связано с возрастанием заряда ядра. По этой же причине увеличивается и энергия ионизации. Плотность также монотонно возрастает. Температуры же плавления и кипения имеют тенденцию к понижению с увеличением порядкового номера (температура плавления скандия 1539°С, а цинка 419,5°С).
Химия 4 d - и 5 d -элементов сходна с химией 3 d -элементов. В периодической системе переходные элементы с аналогичной электронной структурой выделяют в самостоятельные побочные подгруппы (например, подгруппа меди включает медь, серебро и золото, подгруппа цинка — цинк, кадмий и ртуть, и т. д.).
Важнейшими химическими свойствами d -металлов являются следующие:
· - все d -элементы – металлы, отличающиеся от s -металлов меньшей восстановительной способностью и иногда химической инертностью;
· - для большинства d -элементов характерно проявление двух или нескольких степеней окисления, сравнимых по термодинамической устойчивости в обычных условиях. Это значит, что для них характерно большое число окислительно-восстановительных реакций;
· - многие d -элементы в высших степенях окисления проявляют кислотные свойства, а в низших – слабо основные;
· - самой характерной особенностью переходных d -элементов, отличающих их от непереходных, является исключительная способность к образованию различных комплексных соединений, многие из которых устойчивы в водных растворах;
· - в отличие от соединений s -металлов большинство соединений d -элементов обладает характерными окрасками.
Для d -элементов существуют не все возможные степени окисления. Например, у элементов VIIIВ подгруппы степень окисления +8 достигается у Fe, Ru и Os. Некоторые электронные конфигурации и соответствующие им степени окисления обладают повышенной устойчивостью. Так, устойчивы все высшие степени окисления для каждого из 3 d -металлов: от Sc(III) до Mn(VII). Кроме того, устойчивы степени окислении +2 у всех 3d-металлов, начиная с Mn+2 до Zn2+ включительно, а также степени окисления +3 для Sc, Cr, Fe.
В высших степенях окисления переходные металлы теряют все валентные s - и d -электроны. Вместе с этим в определенной степени утрачиваются специфические свойства d -металлов. Соединения, содержащие переходные металлы в высших степенях окисления, по своим физическим и химическим свойствам очень схожи с аналогичными соединениями p -элементов тех же групп. Сравнение физических и химических свойств высших оксидов 3 p - и 3 d -элементов показывает, что они имеют близкие структурные характеристики, агрегатное состояние, способность переходить в парообразное состояние. Существенно различается только окраска: оксиды 3 p -элементов бесцветны, а оксиды 3 d -элементов окрашены, начиная с V2O5.
Сходство в химических свойствах оксидов 3 p - и 3 d -элементов еще больше: аналогичны формулы оксидов, соответствующих им гидроксидов, кислот и солей; с ростом порядковых номеров элементов кислотные и окислительные свойства быстро нарастают, а склонность к образованию полимеров уменьшается. Эти изменения происходят так, что аналогичные пары соединений 3 p - и 3 d -элементов имеют совпадающие или близкие качественные характеристики (табл. 5).
В подгруппах свойства соединений d -элементов в высших степенях окисления изменяются слабее, чем в переходном ряду.
Оксиды и галогениды 3 d -металлов в их низших степенях окисления отвечают стехиометрическим формулам МО, М2О3, МГ2 и МГ3 и изредка М2О и МГ.
Оксиды МО образуют все 3 d -металлы, кроме скандия. Это кристаллические тугоплавкие вещества. Их окраска чаще всего черная или темная с оттенками, ZnO - белый. Они нерастворимы в воде, но растворимы в кислотах. Их получают прокаливанием гидроксидов М(ОН)2 или солей летучих кислот, прежде всего карбонатов МеСО3. Гидроксиды Ме(ОН)2 в момент получения - рыхлые студенистые вещества, имеющие разнообразную окраску. Их получают из растворов солей при добавлении сильных оснований. При длительном выдерживании многие гидроксиды d -элементов приобретают кристаллическую структуру. Гидроксиды переходных металлов, имеющие состав Ме(ОН)2, – чаще всего
Таблица 5
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1221; Нарушение авторских прав?; Мы поможем в написании вашей работы!