
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
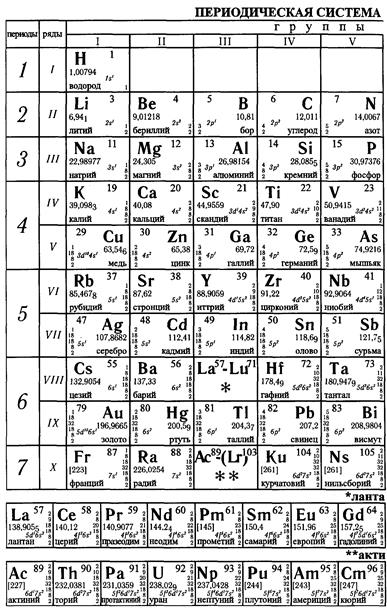
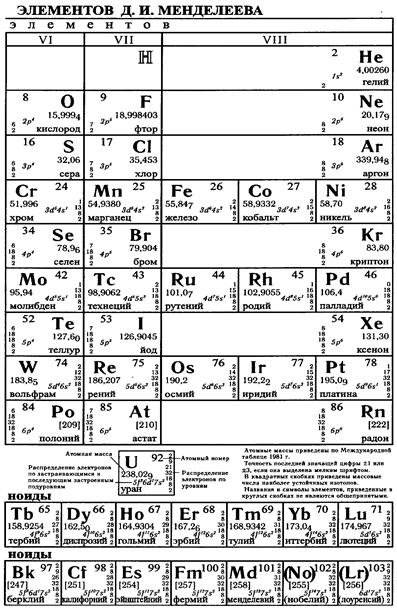
Химические свойства высших оксидов 3p- и 3d-элементов
|
|
|
|
| Характерные соединения и их свойства | Группа периодической системы | ||||
| III | IV | V | VI | VII | |
| 3 p -элементы | |||||
| Оксид | Al2O3 | SiO2 | P4O10 | SO3 | Cl2O7 |
| Степень окисления | +3 | +4 | +5 | +6 | +7 |
| Гидроксид или кислота | Al(OH)3 | SiO2∙ x H2O | H3PO4 | H2SO4 | HClO4 |
| Кислотно- ос-новные свойства | Амфотерное основание | Очень слабая кислота | Слабая кислота | Сильная кислота | Очень сильная кислота |
| Соль гидроксида или кис-лоты с NaOH | Na3[Аl(ОН)6] | Na2SiO3 | Na3PO4 | Na2SO4 | NaClO4 |
| Окислительно-восстановительные свойства | Не выражены | Не выражены | Очень слабый окислитель | Сильный окислитель | Очень сильный окислитель |
| 3 d -элементы | |||||
| Оксид | Sc2O3 | TiO2 | V2O5 | CrO3 | Mn2O7 |
| Степень окис-ления | +3 | +4 | +5 | +6 | +7 |
| Гидроксид или кислота | Sc(OH)3∙ n H2О | Ti(OH)4∙ n H2O | H3VO4 | H2CrO4 | HMnO4 |
| Кислотно- ос-новные свойства | Амфотерное основание | Амфотерное основание | Слабая кислота | Сильная кислота | Очень сильная кислота |
| Соль гидроксида или кис-лоты с NaOH | Na3[Sc(ОН)6] | Na2TiO3 | Na3VO4 | Na2CrO4 | HMnO4 |
| Окислительно-восстановительные свойства | Не выражены | Не выражены | Cлабый окислитель | Сильный окислитель | Очень сильный окислитель |
нерастворимые в воде слабые основания. Гидроксиды меди Сu(ОН)2 и цинка Zn(OH)2 – амфотерны. Гидроксиды марганца Мп(ОН)2, никеля Ni(OH)2, кобальта Со(ОН)2, меди Сu(ОН)2 и цинка Zn(OH)2 легко растворяются в концентрированных растворах аммиака с образованием комплексных соединений, в которых молекулы NH3 играют роль лигандов.
Оксиды М2О3 образуют все 3 d -металлы, за исключением никеля и цинка. Устойчивы Sc2O3, V2O3, Cr2O3 и Fe2O3. Их также получают из солей осаждением гидроксидов Ме(ОН)3 и последующим прокаливанием. Они представляют собой темные с оттенками или черные кристаллические вещества, нерастворимые в воде и растворимые в кислотах.
Разнообразные по окраске аморфные студенистые гидроксиды Ме(ОН)3 образуются при добавлении растворов сильных оснований или аммиака к растворам солей, содержащим катионы Ме3+. Некоторые из них проявляют амфотерные свойства и легко растворяются не только в растворах кислот, но и в растворах сильных оснований. Гидроксиды металлов, у которых степень окисления +3 неустойчива, легко окисляются.
Безводные галогениды МеГ2 и МеГ3 3 d -металлов – соли, обладающие разнообразными окраскам. При образовании кристаллогидратов и растворении в воде окраска галогенидов в большинстве случаев резко изменяется вследствие образования катионами координационных сфер, включающих разное число молекул воды и галогенид-ионов.
В водных растворах небольшие по размерам двух- и трехзарядные катионы d -элементов подвергаются сильной гидратации с образованием двух гидратных оболочек. Аквакатионы представляют собой комплексные катионы, лигандами в которых служат молекулы воды первичной гидратной оболочки.
Устойчивость водных растворов, содержащих гидратированные катионы d -металлов, определяется одновременным протеканием двух процессов: гидролиза и окислительно-восстановительных реакций с водой и растворенным в ней кислородом.
Гидролиз по катиону происходит тем в большей степени, чем меньше радиус негидратированного катиона и чем больше его заряд.
Задачи для самостоятельного решения
261. Как можно осуществить переход от одного соединения меди(II) к другому:
Cu → Cu(NO3)2 → [Cu(NH3)4](NO3)2 → CuS → Cu(NO3)2 →CuO→ → CuCl2 → Cu?
В чем заключается биогенная роль меди?
262. В результате каких процессов медь покрывается на воздухе зеленоватым налетом, а серебро – черным? Напишите уравнения реакций. Как очистить поверхность этих металлов?
263. Кусочек латуни (сплава меди с цинком) растворили в азотной кислоте. Раствор разделили на две части: к одной части прибавили избыток аммиака, а к другой – избыток щелочи. В виде каких соединений в растворе или осадке находятся цинк и медь в обоих случаях? Запишите уравнения всех происходящих реакций.
264. Как объяснить растворение золота в “царской водке”, в растворе цианида калия? Напишите уравнения реакций.
265. Металлическая ртуть часто содержит примеси “неблагородных” металлов – цинка, олова, свинца. Для их удаления ртуть обрабатывают раствором Hg(NO3)2. На чем основан такой способ очистки ртути? Что обусловливает высокую токсичность соединений ртути?
266. При прибавлении цинка к подкисленному серной кислотой раствору ванадата аммония происходит постепенное изменение окраски раствора от желтой через синюю и зеленую к фиолетовой. Это связано с постепенным восстановлением ванадия водородом в момент выделения, в результате чего степень окисления ванадия меняется от +5 до +2. Считая, что в первой стадии образуется VOSO4, во второй – V2(SO4)3, в третьей – VSO4, составьте молекулярные и ионные уравнения реакций для каждой стадии.
267. Почему в основном состоянии хром и молибден имеют электронные конфигурации (n -1) d 5 ns 1, а не (n -1) d 4 ns 2? Какие степени окисления характерны для хрома, молибдена и вольфрама? Приведите примеры соответствующих соединений.
268. Напишите уравнения реакций, которые характеризуют кислотно-основные свойства гидратированных оксидов: Cr(OH)2, Cr(OH)3, H2CrO4. Как изменяются окислительные (восстановительные) свойства у хрома различной степени окисления?
269. Какое химическое свойство дихроматов позволяет использовать их в санитарно-гигиенической практике? Что такое хромовая смесь? На чем основано ее моющее действие? Почему хромовая смесь чаще используется при работе с органическими веществами, чем с неорганическими?
270. Что наблюдается при взаимодействии водных растворов хлорида хрома (III) и гидроксида натрия (калия), взятого в избытке? В состав какого иона входит хром(III)? Какой состав имеет соединение хрома(III), полученное сплавлением оксида хрома(III) со щелочью? Напишите уравнения соответствующих реакций.
271. Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) хромат калия → дихромат калия → хромовый ангидрид;
б) дихромат калия → хромат калия → оксид хрома(III) → металлический хром → хлорид хромила.
272. Приведите электронную конфигурацию атома марганца. Какие степени окисления может проявлять марганец? Каким соединениям марганца они соответствуют? Какие элементы являются аналогами марганца?
273. Чем объяснить, что при большом различии в свойствах соединений марганца и хлора в низших валентных состояниях соединения этих же элементов в высших валентных состояниях имеют сходство? Объясните, почему марганцевая и хлорная кислоты относятся к числу сильных кислот? Какова их устойчивость?
274. Какие из соединений: MnCl2, Mn(OH)2, MnS, MnSO4 во влажном состоянии неустойчивы на воздухе? Что с ними происходит? Напишите уравнения реакций.
275. Напишите уравнения реакций, характеризующих окислительные свойства перманганат-иона в различных средах (кислой, ней-тральной, щелочной). Какие изменения в растворах наблюдаются в каждом случае?
276. Какие продукты получаются при действии на перманганат калия концентрированной серной и соляной кислот. Напишите уравнения реакций.
277. Как можно показать, что оксиды и гидроксиды кобальта(II) и никеля(II) имеют только основной характер? Одинакова ли устойчивость степени окисления +2 для Fe, Co и Ni? Покажите это на примере свойств их гидроксидов.
278. Окислителем или восстановителем является ион Fe3+ в химических реакциях? Приведите уравнения реакций, подтверждающие ответ на этот вопрос.
279. Как получают хлориды железа(II) и (III)? Каким путем можно перевести соединения железа(II) в соединения железа(III) и наоборот? Напишите уравнения реакций.
Для чего используются препараты железа(II) в фармакологической практике?
280. Безводные соли никеля имеют желтую окраску, а их растворы – зелёную, которая меняется на синюю при добавлении раствора аммиака? Чем объяснить эти изменения?
Список использованной литературы
1. Шиманович И.Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов. – М.: Высшая школа, 1998. – 128 с.
2. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2001. – 744 с.
3. Павлов Н.Н. Общая и неорганическая химия: – М.: Дрофа, 2002. – 448 с.
4. Глинка Н.Л. Общая химия. – Л.: Химия, 2002. – 728 с.
5. Угай Я.А. Общая и неорганическая химия. – М.: Высшая школа, 1997. –527 с.
6. Гельфман М.И., Юстратов В.П. Химия. – СПб.: Издательство «Лань», 2000. – 480 с.
7. Коровин Н.В. Общая химия. - М.: Высшая школа, 1998. – 445 с.
8. Зайцев О.С. Химия. Современный краткий курс. – М.: Агар, 1997. – 416 с.
9. Неорганическая химия: В 3-х т. /Под ред. Ю.Д.Третьякова. Т.1.: Физико-химические основы неорганической химии. – М.: Изд. Центр «Академия», 2004. – 240 с.
10. Неорганическая химия в: 3 т. /Под ред. Ю.Д.Третьякова. Т.2: Химия непереходных элементов. – М.: Издательский центр «Академия», 2004. – 368 с.
11. Спицын В.И., Мартыненко Л.И. Неорганическая химия. Ч.I: Учебник. – М.: Изд-во МГУ, 1991. – 408 с.
12. Спицын В.И., Мартыненко Л.И. Неорганическая химия. Ч.II: Учебник. – М.: Изд-во МГУ, 1994. – 624 с.
13. Суворов А.В., Никольский А.Б. Общая химия. – СПб.: Химия, 1997. – 624 с.
14. Скорик Н.А., Козик В.В. Общая химия. Лабораторные, семинарские и практические занятия: Учебное пособие. – Томск: Томский государств. ун-т, 2004. – 448 с.
15. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1997. – 240 с.
16. Витинг Л.М., Резницкий С.И. Задачи и упражнения по общей химии. – М.: МГУ, 1995. – 221 с.
17. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. – М.: Высшая школа, 1997. – 384 с.
18. Краткий справочник физико-химических величин. /Под ред. А.А. Равделя и А.М. Пономаревой. – Л.: Химия, 1983. 232 с.
Рекомендуемая литература (основная)
1. Павлов Н.Н. Общая и неорганическая химия: – М.: Дрофа, 2002. – 448 с.
2. Угай Я.А. Общая и неорганическая химия. – М.: Высшая школа, 1997. –527 с.
3. Гельфман М.И., Юстратов В.П. Химия. – СПб.: Издательство «Лань», 2000. – 480 с.
4. Коровин Н.В. Общая химия. – М.: Высшая школа, 1998. – 455 с.
5. Князев Д.А., Смарыгин С.Н. Неорганическая химия. – М.: Дрофа, 2005. – 591 с.
6. Зайцев О.С. Химия. Современный краткий курс. – М.: Агар, 1997. – 416 с.
7. Артеменко А.И. Органическая химия. – М.: Высшая школа, 2003. – 559.с.
8. Скорик Н.А., Козик В.В. Общая химия. Лабораторные, семинарские и практические занятия. – Томск: Изд-во ТГУ, 2004. – 454 с.
9. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1997. – 240 с.
10. Витинг Л.М., Резницкий С.И. Задачи и упражнения по общей химии. – М.: МГУ, 1995. – 221 с.
Рекомендуемая литература (дополнительная)
1. Неорганическая химия: В 3-х т. /Под ред. Ю.Д. Третьякова. Т.1.: Физико-химические основы неорганической химии. – М.: Изд. Центр «Академия», 2004. – 240 с.
2. Неорганическая химия в: 3 т. /Под ред. Ю.Д. Третьякова. Т.2: Химия непереходных элементов. – М.: Издательский центр «Академия», 2004. – 368 с.
3. Хаускрофт К., Констебл Э. Современный курс общей химии: В 2-х т. – М.: Мир, 2002. – Т. 1, 539 с., т. 2, 528 с.
4. Некрасов Б.В. Основы общей химии. Т. 1, 2. – СПб: Лань, 2003. – 656; 688 с.
5. Фримантл М. Химия в действии: В 2-х т. – М.: Мир, 1998. – Ч. 1, 528 с.; ч. 2, 620 с.
6. Глинка Н.Л. Общая химия. – Л.: Химия, 1980. – 702 с.
7. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. – М.: Химия, 1985. – 632 с.
8. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 1988. – 639 с.
9. Павлов Н.Н., Фролов В.И., Фролов С.В., Дубанкова Н.П. Сборник задач и упражнений по общей и неорганической химии. – М.: Дрофа, 2005. – 239 с.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2082; Нарушение авторских прав?; Мы поможем в написании вашей работы!