
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика и равновесие
|
|
|
|
Скорость химической реакции и связанный с ней механизм протекания изучает химическая кинетика. При определении скоростей учитывается, что реакции могут быть гомогенными – протекающими в однофазной системе или гетерогенными – протекающими в системах, состоящих более чем из одной фазы.
Скорость гетерогенных процессов измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единицу поверхности раздела фаз: 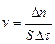 , где Δ n = n 2 – n 1, n 2 и n 1 – количество вещества в момент времени τ 2 и τ 1, Δ τ = τ 2 – τ 1, S – площадь поверхности.
, где Δ n = n 2 – n 1, n 2 и n 1 – количество вещества в момент времени τ 2 и τ 1, Δ τ = τ 2 – τ 1, S – площадь поверхности.
В случае гомогенных реакций скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единицу объёма системы: 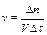 . Так как
. Так как 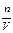 – молярная концентрация С, а
– молярная концентрация С, а 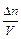 – ее изменение Δ С, то средняя скорость
– ее изменение Δ С, то средняя скорость 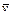 за отрезок времени Δ τ равна отношению
за отрезок времени Δ τ равна отношению 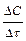 . Если Δτ стремится к нулю, то в пределе средняя скорость
. Если Δτ стремится к нулю, то в пределе средняя скорость 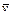 становится скоростью в данный момент времени или истинной скоростью v, которая равна производной от концентрации по времени:
становится скоростью в данный момент времени или истинной скоростью v, которая равна производной от концентрации по времени: 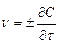 . Знак определяется направлением изменения концентрации вещества: плюс означает ее увеличение, а минус – уменьшение. Так, скорость реакции:
. Знак определяется направлением изменения концентрации вещества: плюс означает ее увеличение, а минус – уменьшение. Так, скорость реакции:
H2 + I2 → 2HI
может быть выражена (при обозначении концентрации вещества квадратными скобками) следующим образом:

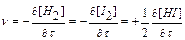 .
.
Скорость химической реакции зависит от: 1) природы реагирующих веществ; 2) условий, при которых протекает реакция: концентрации реагирующих веществ, температуры, давления (для газов), облучения светом и др.,3) присутствия катализаторов.
Зависимость скорости реакции от концентрации выражается законом действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степени некоторых чисел, определяемых опытным путем.
В общем случае для реакции aA + bB = cC закон действующих масс выражается уравнением:
v=kCA α ∙CB β,
где α и β – некоторые числа, определяемые опытным путем, k – коэффициент пропорциональности, который называется константой скорости химической реакции.
Если концентрации веществ равны единице, то v=k. Константа скорости зависит от температуры и природы реагирующих веществ, но не от их концентрации. Значение k для различных реакций при одной и той же температуре дает сравнительную характеристику способности веществ к взаимодействию при этой температуре.
Уравнения подобного типа, выведенные на основе экспериментальных данных зависимости скорости от концентрации реагирующих веществ, называют кинетическими уравнениями реакции.
Для элементарных реакций, т.е. реакций, протекающих в одну стадию и именно так, как записано уравнение, показатель степени при концентрации данного вещества совпадает с его стехиометрическим коэффициентом в уравнении реакции. Таким образом, для элементарной реакции A + B→C скорость согласно закону действующих масс выражается уравнением: v=kCACB.
При гетерогенных реакциях концентрации веществ, находящихся в твёрдой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действующих масс.
Пример 1. Реакция между оксидом азота (II) и хлором протекает по уравнению: 2NO + Cl2 ⇄ 2NOCl. Как изменится скорость данной элементарной реакции при увеличении а) концентрации оксида азота (II) в два раза; б) давления в 2 раза?
Решение:
а) Обозначим концентрации NO и Cl2 соответственно через a и b. В соответствии с законом действующих масс выражение для скорости реакции имеет вид: v1=ka2b. После увеличения концентрации NO в два раза она будет равна 2 a, поэтому v2=k(2a)2b=k4a2.b. Увеличение скорости реакции по отношению к первоначальной определяется соотношением: 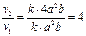 .
.
б) Увеличение давления во столько же раз повышает концентрации газообразных веществ NO и Cl2. Они соответственно станут равными 2 a и 2 b. Поэтому
v2=k(2a)2 2b=k8a2.b.
Увеличение скорости реакции составит: 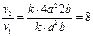 .
.
Ответ: Увеличится а) в 4 раза; б) в 8 раз.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
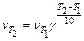 ,
,
где 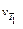 и
и 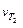 – скорость реакции при температуре Т1 и Т2 соответственно, Т 2> Т 1; γ – температурный коэффициент скорости реакции, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 0С. Для большинства реакций при обычных температурах значения γ находятся в пределах 2 – 4.
– скорость реакции при температуре Т1 и Т2 соответственно, Т 2> Т 1; γ – температурный коэффициент скорости реакции, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 0С. Для большинства реакций при обычных температурах значения γ находятся в пределах 2 – 4.
Пример 2. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 50 раз? Температурный коэффициент скорости реакции равен 1,8.
Решение: Найдем значение Δ Т = Т 2 – Т 1, при котором отношение: v 2/ v 1=50.
Согласно правилу Вант-Гоффа 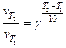 , отсюда
, отсюда
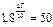 или
или 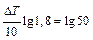 . Следовательно, Δ Т =67 0С.
. Следовательно, Δ Т =67 0С.
Ответ: На 67 0С.
Как следует из уравнения Вант-Гоффа, скорость реакции сильно возрастает с повышением температуры. Это связано с тем, что элементарный акт химической реакции протекает не при всяком столкновении реагирующих молекул: реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым создать возможность образования новых молекул. Поэтому каждая реакция характеризуется определённым энергетическим барьером. Для его преодоления необходима энергия активации – некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т.е. привело бы к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Зависимость константы скорости реакции k от температуры выражается уравнением Аррениуса:
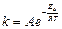 ,
,
где А – постоянная величина для данной реакции; е – основание натурального логарифма (е =2,718); R – универсальная газовая постоянная (8,314 Дж·моль-1·К-1); Т – температура, К; Еа – энергия активации.
Как следует из уравнения Аррениуса, константа скорости реакции тем больше, чем меньше энергия активации.
Скорость химической реакции возрастает в присутствии катализатора. Действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции понижается и активными становятся некоторые молекулы, энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. В результате общее число активных молекул возрастает, скорость реакции увеличивается.
Как следует из уравнения Аррениуса, в которое Е а входит в качестве показателя степени, даже небольшое уменьшение энергии активации приводит к значительному возрастанию скорости реакции. Так, под действием биологических катализаторов – ферментов – энергия активации химических реакций, протекающих в живых организмах, резко снижается, и эти реакции достаточно быстро протекают при сравнительно низких температурах.
Пример 3. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300К скорость ее увеличится в 2 раза?
Решение: Обозначим константы скорости реакции при 290 и 300К соответственно k1 и k2. Используя уравнение Аррениуса, находим:
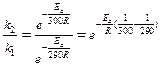 .
.
Известно, что k2 / k1 =2, отсюда 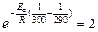 .
.
Выражаем из последнего соотношения энергию активации:
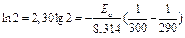 ;
;
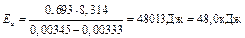 .
.
Ответ: 48,0 кДж.
При протекании химической реакции концентрации исходных веществ уменьшаются. В соответствии с законом действующих масс это приводит к уменьшению скорости реакции. Если реакция обратима, т.е. может протекать как в прямом, так и в обратном направлении, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия. Концентрации реагирующих веществ, установившиеся к моменту наступления равновесия, называются равновесными, они остаются постоянными до нарушения химического равновесия.
Для любой системы, например,
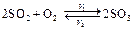
скорости прямой и обратной реакции можно выразить согласно закону действующих масс: v 1= k 1[SO2]2[O2] и v 2= k 2[SO3]2.
С наступлением равновесия v 1= v 2 или k 1[SO2]2[O2]= k 2[SO3]2. Отсюда
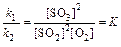
Отношение констант скоростей прямой и обратной реакций называют константой равновесия К. Константа равновесия – постоянная для данной температуры величина, которая также равна произведению равновесных концентраций продуктов реакции, делённому на произведение равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам. Значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции при данной температуре. При К >> 1 произведение концентраций полученных веществ много больше произведения концентраций исходных веществ, поэтому обратимая реакция дает в этом случае большой выход продуктов реакции. При К << 1, наоборот, выход продуктов реакции очень мал. В первом случае равновесие системы сильно смещено в сторону образования продуктов реакции, а во втором – в сторону исходных веществ.
В химической термодинамике доказывается, что для общего случая химической реакции
aA + bB + → cC + dD +…
справедливо аналогичное выражение для константы равновесия химической реакции
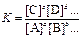 .
.
Константа равновесия связана с изменением основных термодинамических характеристик соотношением:
– RT· ln K = Δ G, отсюда ln K = –Δ G / RT.
Чем отрицательнее значения Δ G, тем численно больше константа равновесия, тем сильнее смещается равновесие вправо и, наоборот, чем больше положительные значения Δ G, тем сильнее равновесие смещается влево
В выражении константы равновесия гетерогенной реакции, как и в выражение закона действующих масс для скорости реакции, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными. Так, для реакции:
2PbO + O2→2PbO2 v = k [O2].
Для равновесной системы: C + O2 ⇄ 2CO константа равновесия:
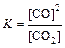 .
.
Катализатор не влияет на значение константы равновесия, поскольку он одинаково снижает энергию активации прямой и обратной реакций и поэтому одинаково увеличивает их скорость. Катализатор лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
Пример 4. Вычислите равновесную концентрацию H2 и I2 в системе: 2HI ⇄ H2 + I2, если исходная концентрация HI составляла 0,05 моль/л, а константа равновесия К =0,02.
Решение: Представим молярный состав системы к моменту наступления равновесия:
2HI ⇄ H2 + I2
Исходные концентрации, моль/л 0,05 - -
Прореагировало, моль/л 2 x - -
Образовалось, моль/л - x x
Равновесные концентрации, моль/л (0,05 – 2 x) x x
Запишем выражение для константы равновесия:
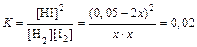 . Отсюда x = 5,5·10-3 моль/л.
. Отсюда x = 5,5·10-3 моль/л.
Ответ: [H2] = [I2] = 5,5·10-3 моль/л.
Пример 5. Равновесные концентрации веществ, участвующих в реакции: 2NO + O2 ⇄ 2NO2 были равны (в моль/л): [NO]=0,060; [O2]= 0,030; [NO2]=0,046. Вычислите исходные концентрации NO и O2.
Решение: Согласно стехиометрическому уравнению реакции на образование 2 моль/л NO2 требуется 2 моль/л NO и 1 моль/л O2. Ниже представлен молярный состав системы к моменту наступления равновесия:
2NO + O2 ⇄ 2NO2
Исходные концентрации, моль/л 0,106 0,053 -
Прореагировало, моль/л 0,046 0,023 -
Образовалось, моль/л - - 0,046
Равновесные концентрации, моль/л 0,060 0,030 0,046
Исходные концентрации NO и O2 равны сумме прореагировавших и оставшихся равновесных концентраций.
Ответ: И сходные концентрации NO и O2 соответственно равны 0,106 и 0,053моль/л.
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в том направлении, в котором оказанное воздействие будет ослаблено.
Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы. Повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ в направлении, приводящем к понижению давления. Удаление из системы одного из продуктов реакции ведёт к смещению равновесия в сторону прямой реакции. Уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции.
Пример 5. Как повлияет на выход хлора в системе:
4HCl (г) + O2 (г) ⇄ 2Сl2 (г) + 2H2O (ж); Δ H 0= –202,4 кДж
а) повышение температуры в реакционном объеме; б) уменьшение общего объема системы; в) уменьшение концентрации кислорода;
г) увеличение объема раствора; д) введение катализатора?
Решение:
а) Данная реакция протекает с выделением теплоты (Δ H 0<0), поэтому согласно принципу Ле Шателье выход хлора увеличится при понижении температуры до такого ее значения, при котором скорость реакции еще достаточна для относительно быстрого достижения равновесия.
б) Протекание реакции в прямом направлении сопровождается уменьшением общего числа молей газообразных веществ, т.е. понижением давления в системе. Уменьшение общего объема системы приведет к повышению давления, а значит, вызовет смещение равновесия в сторону прямой реакции – увеличения выхода хлора.
в) Уменьшение концентрации кислорода – одного из исходных веществ, приведет к сдвигу равновесия в направлении обратной реакции, т.е. понизит выход хлора.
г) Увеличение объема раствора
д) Введение катализатора лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2893; Нарушение авторских прав?; Мы поможем в написании вашей работы!