
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. Сероводород при обычной температуре – газ, а вода – жидкость
|
|
|
|
Сероводород при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в свойствах?
Решение: Кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Межмолекулярные взаимодействия существуют между молекулами в жидкостях, кристаллах, в реальных газах. Этот тип связи не сопровождается дополнительным обобществлением электронной плотности, а основан на взаимодействии диполей. Понятие о межмолекулярном взаимодействии впервые было введено голландским ученым Ван-дер-Ваальсом, поэтому силы этого взаимодействия называют ван-дер-ваальсовыми. Они обусловлены тремя типами слабого взаимодействия: ориентационным, индукционным, дисперсионным.
Ориентационное взаимодействие возникает при сближении двух полярных молекул, имеющих постоянный дипольный момент, например HCl (μ =1,05 D), SO2 (μ =1,63 D) в жидком и твердом состоянии. Оно тем значительнее, чем больше дипольный момент молекул и меньше расстояние между ними.
Индукционное взаимодействие возникает между полярной и неполярной молекулами, при условии, что неполярная молекула способна поляризоваться под действием полярной молекулы, например, в растворе I2 в спирте. Индукционный эффект возрастает с увеличением поляризуемости молекулы.
Дисперсионное взаимодействие возникает между неполярными молекулами. В неполярных молекулах распределение электронной плотности симметрично и дипольный момент отсутствует. Тем не менее, электронные облака постоянно колеблются относительно ядер, образуя временные или мгновенные диполи. Мгновенный диполь одной молекулы индуцирует мгновенный диполь в другой молекуле. Дипольные моменты обеих молекул направлены в одну сторону, что вызывает притяжение молекул. Дисперсионные взаимодействия присутствуют в молекулах неполярных и полярных веществ. Переход газов (O2, H2, N2 и др.) в жидкое и твердое состояние обусловлен дисперсионным притяжением молекул.
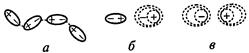
Рис. 14. Типы межмолекулярных взаимодействий:
а – ориентационное, б – индукционное, в – дисперсионное
Силы межмолекулярного взаимодействия по сравнению с обычными валентными силами ненасыщаемы, имеют низкую энергию, действуют на небольших расстояниях. Например, энергия связи Cl-Cl составляет 245 кДж/моль, а энергия связи между молекулами Cl2 в кристалле хлора на порядок ниже и составляет 25 кДж/моль. Сила межмолекулярного взаимодействия возрастает с увеличением размеров молекул.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2393; Нарушение авторских прав?; Мы поможем в написании вашей работы!