
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
|
|
|
|
| Квантовый | Магнитное квантовое число | Число квантовых состояний (орбиталей) | Макси-мальное число электронов | |||||
| уровень | подуровень | в подуров-не (2/+1) | в уровне п | в подуров-не 2(2/+1) | в уровне 2 n 2 | |||
| обозна-чение | главное кванто-вое число п | обозна-чение | орби-тальное кванто-вое число/ | |||||
| К | s | |||||||
| L | s | |||||||
| p | -1; 0; +1 | |||||||
| М | s | |||||||
| р | -1; 0; +1 | |||||||
| d | -2;-1;0;+1;+2 | |||||||
| N | s p d f d | -1; 0; +1 -2;-1,0;+1;+2 -3; -2; -1; 0; +1; +2; +3 |
Изучение тонких эффектов в атомных спектрах показало, что для полного описания электрона в атоме недостаточно трех квантовых чисел. Электрон, обладая электрическим зарядом, проявляет собственное движение, которое приводит к возникновению собственного магнитного момента. Для характеристики этого свойства электрона было введено спиновое квантовое число – s, принимающее два значения +1/2 и -1/2.
Таким образом, состояние электрона в атоме полностью определяется четырьмя квантовыми числами, три из которых (n, l, m) характеризуют атомную орбиталь, а четвертое (s) – собственный магнитный момент электрона.
Однако в атоме обычно присутствуют не один, а несколько электронов. В таких атомах электроны занимают орбитали, аналогичные атому водорода, но энергия орбиталей отличается от энергии АО атома водорода. Это объясняется бoльшим положительным зарядом ядра, экранированием этого ядра заполненными внутренними орбиталями, межэлектронным отталкиванием. Экспериментально установлен (на основании наблюдения атомных спектров, энергий ионизации, расчетов) следующий порядок расположения атомных орбиталей по возрастанию их энергии:
1 s <2 s <2 p <3 s <3 p <4 s ~3 d <4 p <5 s ~4 d <5 p <6 s ~4 f ~5 d <6 p <7 s ~6 d ~5 f <7 s
Эта последовательность АО характерна для любого атома. Учитывая ее, а также принцип наименьшей энергии, принцип Паули, и правило Хунда, можно определить электронную конфигурацию произвольного атома.
Согласно принципу наименьшей энергии (или энергетической выгодности) электрон в атоме всегда стремится занять орбиталь с наименьшей энергией.
Например, в приведенной выше энергетической последовательности уровней электрон из 3-х подуровней 3 s, 3 p, 3 d займет низший 3 s -подуровень.
В соответствии с принципом Паули в атоме не может быть электронов с одинаковым набором всех 4-х квантовых чисел n, l, m, s (электроны должны отличаться хотя бы одним квантовым числом). Отсюда следует, что на одной орбитали может находиться не более двух электронов, отличающихся спинами. Пользуясь принципом Паули, можно определить максимальное число электронов, которое может находиться на энергетическом уровне.
Из данных таблицы 1 легко сделать вывод о том, что максимальное число электронов в электронном слое составляет N e=2 n 2.
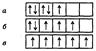
Правило Хунда: заполнение вырожденных орбиталей электронами происходит таким образом, чтобы атом имел в данном подуровне максимальное число параллельных спинов (т.е., чтобы ΣS электронов была максимальной для данного значения l). Это значит, что сначала на каждой орбитали данного подуровня располагается по одному электрону, а затем по второму с противоположно направленным спином. Например, заселение d -АО электронами в соответствии с правилом Хунда возможно только способом (в):
Зная заряд ядра атома (а значит число электронов в электронной оболочке) и порядок заполнения атомных орбиталей электронами, можно определить электронную конфигурацию атома.
Для этого существует два основных способа:
1) электронные формулы,
2) электронографические формулы (или квантовые ячейки).
Электронные формулы атомов или ионов можно записать в полной и сокращенной форме (включив в электронную формулу конфигурацию атома благородного газа):
Na: 1 s 22 s 22 p 6 3 s 1 – полная электронная формула
(подчеркнут валентный уровень),
значения квантовых чисел для валентных электронов: n =3, l =0.
Na: 1 s 22 s 22 p 6 3 s 1 → [Ne]3 s 1 - сокращенная электронная формула
[Ne]
Суммарное число электронов в квантовых слоях можно указать так:
2, 8, 18 и т.д. или 2) 8) 18) …
Более полно состояние электронов в атоме описывает электронографическая формула, отражающая все 4 квантовых числа. Каждой ячейке отвечает определенная орбиталь, электрон изображается в виде стрелки, направление которой соответствует значению спинового квантового числа (условно "↑": s =+1/2; "↓": s =-1/2).
Так, для атома азота электронографическая формула имеет вид:

Для 5-ти валентных электронов атома N можно записать следующие наборы квантовых чисел (эту запись удобно представлять в виде таблицы):
| № е | n | l | m | s |
| +1/2 | ||||
| -1/2 | ||||
| +1 | +1/2 | |||
| +1/2 | ||||
| -1 | +1/2 |
Полностью или наполовину заполненный подуровень отличается повышенной устойчивостью. Для некоторых атомов, например, Cr и Cu, в связи с небольшой разницей в энергии 3 d - и 4 s -АО наблюдается “проскок” электрона, т.е. более выгодными оказываются конфигурации:
Cr: [Ar]3 d 54 s 1 (вместо [Ar]3 d 44 s 2),
Cu: [Ar]3 d 104 s 1 (вместо [Ar]3 d 94 s 2).
Учение о строении атома является теоретическим обоснованием периодического закона, сформулированного в 1869 г. Д.И. Менделеевым: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от атомных весов элементов. Не вдаваясь в историю открытия закона, отметим, что Д.И. Менделеев считал основной фундаментальной характеристикой элемента его атомную массу. Позже, в 1913 г., английский физик Мозли определил заряды ядер атомов элементов и установил, что порядковый номер элемента в периодической системе соответствует заряду его ядра. Таким образом, оказалось, что основной характеристикой атома является заряд ядра. Вследствие этого в формулировку периодического закона были внесены изменения: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер атомов элементов.
Причина периодичности свойств элементов стала понятна только после определения электронного строения атома. Она заключается в сходстве конфигураций внешних электронных орбиталей атомов в невозбужденном состоянии и определяется периодичностью повторения строения внешних электронных уровней. Так, атомы галогенов (F, Cl, Br, I, At), обладающие сходными химическими свойствами, имеют на внешнем электронном уровне семь электронов (n s 2n p 5), щелочные металлы (Li, Na, K, Rb, Cs, Fr) – один электрон (n s 1).
Периодическая система элементов является графическим выражением периодического закона. Самое ценное ее свойство заключается в том, что она отражает строение атома любого химического элемента.
Элементы располагаются в таблице в порядке возрастания заряда ядра. Вертикальные столбцы элементов называют группами, а горизонтальные ряды – периодами. Каждая группа подразделяется на две подгруппы – главную и побочную, их обозначают соответственно А и В.
Периоды объединяют элементы, в атомах которых происходит последовательное заполнение одинаковых электронных уровней. Номер периода совпадает с количеством уровней в электронной оболочке атома и со значением главного квантового числа внешнего электронного уровня. Число элементов в периоде соответствует количеству электронов, необходимых для заполнения внешнего электронного уровня.
| № периода | Число уровней в электронной оболочке атома | Число заполняемых орбиталей на внешнем уровне | Элементы | Кол-во элементов в периоде |
| I | 1 (1 s) | H, He | ||
| II | 4 (2 s -1АО 2 p -3АО) | Li, Be, B, C, N, O, F, Ne | ||
| III | 4 (3 s -1АО 3 p -3АО, 3 d - пустой) | Na, Mg, Al, Si, P, S, Cl, Ar |
Различие в энергетической последовательности заполнения внешних и более близких к ядру электронных уровней объясняет причину различной длины периодов: 1-й период содержит 2 элемента, 2-й и 3-й – по 8 элементов, 4-й и 5-й – по 18 элементов,
6-й – 32 элемента.
В вертикальных колонках периодической системы находятся группы элементов, атомы которых имеют одинаковое количество электронов на внешнем (валентном) уровне.
Например, у элементов V группы на внешнем уровне пять электронов: N (2 s 22 p 3), P (3 s 23 p 3), As (4 s 24 p 3), Sb (5 s 25 p 3), Bi (6 s 26 p 3).
По типу валентных орбиталей все элементы делятся на электронные семейства. Элементы, имеющие конфигурацию внешних орбиталей n s 1 и n s 2, образуют s-семейство. Элементы, у которых происходит заполнение внешнего p -подуровня, объединяют в p-семейство. Элементы с заполняющимися (n -1) d - и (n -2) f -орбиталями образуют соответственно d- и f-семейства.
Элементы s- и p-семейств составляют главные подгруппы периодической системы, их атомы имеют валентные электроны только на внешнем уровне. Элементы d- и f-семейств образуют побочные подгруппы. Элементы побочных подгрупп называют переходными.
У атомов элементов побочных подгрупп валентными являются электроны не только внешнего, но и предвнешнего уровня. Например:
S и Cl – элементы главных подгрупп: VIА и VIIА соответственно. Валентные электроны атомов S (3 s 23 p 4 – шесть электронов) и Cl (3 s 23 p 5 – семь электронов) расположены на внешних уровнях.
Cr и Mn – элементы побочных подгрупп: VIB и VIIB соответственно, валентные электроны Cr (3 d 54 s 1 – шесть электронов) и Mn (3 d 54 s 2 – семь электронов) находятся на внешнем (4 s) и предвнешнем подуровнях (3 d).
Свойства атомов, хотя и в значительно меньшей степени, но зависят от строения второго снаружи (предвнешнего) уровня, причем влияние структуры предвнешнего уровня тем сильнее, чем меньше электронов на самом внешнем уровне.
Cравним элементы главной и побочной подгрупп VI группы между собой и с характеристическим элементом – серой (табл. 2).
Сопоставление структур электронных оболочек атомов элементов при характерных для них степенях окисления показывает, что в группах периодической системы наблюдается два вида аналогии. В одном из них рассматриваемые элементы имеют однотипные структуры внешних электронных оболочек при любой заданной степени окисления, такие элементы называют полными электронными аналогами. К ним относятся Se и Te. В другом случае однотипность структур наблюдается лишь при некоторых степенях окисления. Таковы, например, по отношению к сере элементы подгруппы Se. Элементы подгруппы Cr также являются полными электронными аналогами по отношению друг к другу. Но в высшей степени окисления (+6) электронными аналогами будут являться сера и элементы подгруппы Cr, имеющие 8е - на внешнем уровне.
Таблица 2
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3460; Нарушение авторских прав?; Мы поможем в написании вашей работы!