
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие методические указания
|
|
|
|
В курсе химии большое место отводится самостоятельной работе студента в освоении материала, которая включает: изучение дисциплины по учебникам и учебным пособиям; выполнение контрольных работ; индивидуальные консультации; посещение лекций; сдачу зачета по лабораторному практикуму; сдачу экзамена (зачета) по всему курсу. И данное пособие дает возможность в полной мере освоить такие темы курса общей и неорганической химии, как окислительно- восстановительные процессы в растворах электролитов, реакции комплексообразования, гидролиза и т.д.
Работа с книгой. Изучать курс рекомендуется по темам. При первом чтении необходимо получить общее представление об излагаемых вопросах, а также отметить трудные или неясные места. При повторном изучении темы следует усвоить все теоретические положения, математические зависимости и их выводы, а также принципы составления уравнений реакций. Для более глубокого и прочного усвоения материала необходимо вникнуть и понять сущность того или иного вопроса, а не пытаться запомнить отдельные факты и явления.
Чтобы лучше запомнить и усвоить изучаемый материал, нужно обязательно иметь рабочую тетрадь и заносить в нее формулировки законов и основные понятия химии, незнакомые термины и названия, формулы и уравнения реакций, математические зависимости и их выводы и т.п. Во всех случаях, когда материал поддается систематизации, нужно составлять графики, схемы, таблицы. Они очень облегчают запоминание и уменьшают объем конспектируемого материала. При изучении курса полезно обращаться к предметному указателю в конце книги. Пока тот или иной раздел не усвоен, переходить к изучению новых разделов не следует. Краткий конспект курса будет полезен при повторении материала в период подготовки к экзамену, зачету.
Изучение курса должно обязательно сопровождаться выполнением упражнений и решением задач (см. список рекомендованной литературы). Решение задач – один из лучших методов прочного усвоения, проверки и закрепления теоретического материала.
Контрольная работа. В процессе изучения курса химии студент должен выполнить контрольную работу для отчета по самостоятельному освоению дисциплины. Она также является формой методической помощи студенту при изучении курса. К выполнению контрольной работы можно приступить только после усвоения определенной части курса и решения примеров типовых задач, приведенных в данном пособии, по соответствующей теме.
Решения задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы, за исключением тех случаев, когда по существу вопроса такая мотивировка не требуется, например, когда нужно составить электронную формулу атома, написать уравнение реакции и т.п. При решении задач нужно приводить весь ход решения и математические преобразования.
Контрольная работа должна быть аккуратно оформлена; для замечаний рецензента нужно оставлять широкие поля; писать четко и ясно; номера и условия задач переписывать в том порядке, в каком они указаны в задании. В конце работы следует дать список использованной литературы с указанием года издания. Работа должна быть датирована, подписана студентом и представлена в университет для рецензирования.
Если контрольная работа не зачтена, ее нужно выполнить повторно в соответствии с указаниями рецензента и выслать на рецензирование вместе с незачтенной работой. Исправления следует вносить в конце тетради, а не в рецензированном тексте.
Таблица вариантов контрольных заданий приведена в начале пособия. Каждый студент выполняет вариант заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 98594, две последние цифры 94, им соответствует вариант контрольного задания 94. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается как сданная.
Таблица вариантов контрольных работ
| № варианта | Номера задач, относящихся к данному варианту |
| 1, 21, 41, 61, 81, 101, 121, 141, 161, 181, 201, 221, 241, 261 | |
| 2, 22, 42, 62, 82, 102, 122, 142, 162, 182, 202, 222, 242, 262 | |
| 3, 23, 43, 63, 83, 103, 123, 10З, 163, 183, 204, 223, 243, 263 | |
| 4, 24, 44, 64, 84, 104, 124, 144, 164, 184, 204 224, 244, 264 | |
| 5, 25, 45, 65, 85, 105, 125, 145, 165, 185, 205 225, 245, 265 | |
| 6, 26, 46, 66, 86, 106, 126, 146, 166, 186, 206 226, 246, 266 | |
| 7, 27, 47, 67, 87, 107, 127, 147, 167, 187, 207 227, 247, 267 | |
| 8, 28, 48, 68, 88, 108, 128, 148, 168, 188, 208 228, 248, 268 | |
| 9, 29, 49, 69, 89, 109, 129, 149, 169, 189, 209 229, 249, 269 | |
| 10, 30, 50, 70, 90, 11О, 130, 150, 170, 190, 210 230, 250, 270 | |
| 11, 31, 51, 71, 91, 111, 131, 151, 171, 191, 211 231, 251, 271 | |
| 12, 32, 52, 72, 92, 112, 132, 152, 172, 192, 212 232, 252, 272 | |
| 13, 33, 53, 73, 93, 113, 133, 153, 173, 193, 213 233, 253, 273 | |
| 14, 34, 54, 74, 94, 114, 134, 154, 174, 191, 214 234, 254, 274 | |
| 15, 35, 55. 75, 95, 115, 135, 155, 175, 195, 215, 235, 255, 275 | |
| 16, 36, 56, 76, 96, 116, 136, 156, 176, 196, 216, 236, 256, 276 | |
| 17. 37, 57, 77, 97, 117, 137, 157, 177, 197, 217, 237, 257, 277 | |
| 18, 38, 58. 78, 98, 118, 138, 158, 178, 198, 218, 238, 258, 278 | |
| 19, 39. 59, 79, 99, 119, 139, 159, 179, 199, 219, 239, 259, 279 | |
| 20, 40, 60, 80, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280 | |
| 1, 22, 43, 64, 85, 106, 127, 148, 169, 190, 211, 222, 243, 264 | |
| 2, 23, 44, 65, 86, 107, 128, 149, 170, 191, 212, 223, 244, 265 | |
| 3, 24, 45, 66, 87. 108, 129, 150, 171, 192, 213, 224, 245, 266 | |
| 4, 25, 46, 67, 88, 109, 130, 151, 172, 193, 214, 225. 246, 267 | |
| 5, 26, 47, 68, 89, 11О, 131, 152, 173, 194, 215, 226, 247, 268 | |
| № варианта | Номера задач, относящихся к данному варианту |
| 6, 27, 48, 69, 90, 111, 132 163, 174, 195, 216, 227, 248, 269 | |
| 7, 28, 49, 70, 91, 112, 133, 154, 175, 196, 217 228, 249, 270 | |
| 8, 29, 50, 71, 92, 11З, 134, 155, 176, 197, 218 229, 250, 271 | |
| 9, 30, 51, 72, 93, 114, 135, 156, 177, 198, 219, 230, 251, 272 | |
| 10, 31, 52, 73,94, 115, 136, 157, 178, 199,220, 231, 252, 273 | |
| 11, 32, 53, 74, 95, 116, 137, 158, 179, 200, 201, 232,253, 274 | |
| 12, 33, 54, 75, 96, 117, 138, 159, 180, 181, 202, 232, 254, 275 | |
| 13, 34, 55, 76, 97, 118, 139, 160, 161, 182, 203, 234, 255, 276 | |
| 14, 35, 56, 77, 98, 119, 140,141, 162, 183, 204, 235, 256, 277 | |
| 15, 36, 57, 78, 99, 120, 121, 142, 163, 184, 205, 236, 257, 278 | |
| 16, 37, 58, 79, 100, 101, 122, 143, 164, 185, 206, 237, 258, 279 | |
| 17, 38, 59, 80, 81, 102, 123, 144, 165, 186, 297, 238,259, 280 | |
| 18, 39, 60, 65, 86, 107, 128, 145, 166, 187, 208, 239, 260, 261 | |
| 19, 40, 44, 65, 87, 108, 129, 146, 167, 188, 219, 240, 241, 262 | |
| 20, 23, 45, 67, 88, 109, 130, 147, 168, 189, 210, 221, 242, 263 | |
| 2, 24, 46, 68, 89, 110, 131, 148, 170, 190, 201, 223, 241, 265 | |
| 2, 24, 46, 68, 89, 110, 131, 148, 170, 190, 201, 223, 241, 265 | |
| 3, 25, 47, 69, 90, 111, 132, 149, 171, 191, 202, 224, 242, 266 | |
| 4, 26, 48, 70, 91, 112, 133, 150, 172, 192, 203, 225, 243, 267 | |
| 5, 27, 49, 71, 92, 113, 134, 151, 173, 193, 204, 226, 244, 268, | |
| 6, 28, 50, 72, 93, 114, 135, 152, 174, 193, 205, 227, 245, 269 | |
| 7, 29, 51, 73, 94, 115, 136, 153, 175, 195, 206, 228, 246, 270 | |
| 8, 30, 52, 74, 95, 116, 137, 154, 176, 196, 207, 229, 247, 271 | |
| 9, 31, 53, 75, 96, 117, 138, 155, 177, 197, 208, 230, 248, 272 | |
| 10, 32, 54, 76, 97, 118, 139, 156, 178, 198, 209, 231, 249, 273 | |
| 11, 33, 55, 77, 98, 119, 140, 157, 179, 199, 210, 232, 250, 274 | |
| № варианта | Номера задач, относящихся к данному варианту |
| 12, 34, 56, 78, 99, 120, 122, 158, 180, 200, 211, 233, 251, 278 | |
| 13, 35, 57, 79, 100, 103, 121, 159, 169, 182, 212, 234, 252, 276 | |
| 14, 36, 58, 80, 85, 104, 123, 160, 161, 183, 213, 235, 253, 277 | |
| 15, 37, 59, 61, 84, 105, 124, 141, 162, 184, 214, 236, 254, 278 | |
| 16, 38, 60, 62, 83, 106, 125, 143, 163, 185, 215, 237, 255, 279 | |
| 17, 33, 41, 63, 82, 101, 126, 142, 164, 186, 216, 238, 256, 280 | |
| 18, 40, 42, 61, 81, 102, 127, 144, 165, 187, 217, 239, 257, 271 | |
| 19, 21, 43, 62, 87, 103, 128, 145, 166, 188, 218, 240, 258, 272 | |
| 20, 22, 41, 63, 88, 104, 129, 146, 167, 189, 219, 223, 259, 273 | |
| 1, 24, 42, 64, 89, 105, 130, 147, 168, 190, 220, 222, 260, 274 | |
| 3, 25, 43, 65, 90, 106, 131, 148, 169, 191, 201, 221, 250, 275 | |
| 4, 26, 44, 66, 91, 107, 132, 149, 170, 192, 202, 222, 251, 276 | |
| 5, 27, 45, 67, 92, 108, 133, 150, 171, 193, 203, 224, 252, 277 | |
| 6, 28, 46, 68, 93, 109, 134, 151, 172, 194, 204, 223, 253, 278 | |
| 7, 29, 47, 69, 94, 110, 135, 152, 173, 195, 205, 225, 254, 279 | |
| 8, 30, 48, 70, 95, 111, 136, 153, 174, 196, 206, 226, 255, 280 | |
| 9, 31, 49, 71, 96, 112, 137, 154, 175, 197, 207, 227, 256, 261 | |
| 10, 32, 50, 72, 97, 113, 138, 155, 176, 198, 208, 228, 257, 262 | |
| 11, 33, 51, 73, 98, 114, 139, 156, 177, 199, 209, 229, 258, 263 | |
| 12, 34, 52, 74, 99, 115, 140, 157, 178, 200, 210, 230, 259, 264 | |
| 13, 35, 53, 75, 100, 116, 121, 158, 179, 181, 211, 231, 260, 266 | |
| 14, 36, 54, 76, 86, 117, 122, 159, 180, 182, 212, 232, 241, 266 | |
| 15, 37, 55, 77, 85, 118, 123, 160, 162, 183, 213, 233, 242, 267 | |
| 16, 38, 56, 78, 84, 119, 124, 142, 161, 184, 214,234, 243, 268 | |
| 17, 39, 57, 79, 83, 120, 125, 141, 163, 185, 215, 235, 244, 269 | |
| 18, 40, 58, 80, 82, 101, 126, 143, 164, 186, 216, 236, 245, 270 | |
| № варианта | Номера задач, относящихся к данному варианту |
| 19, 23, 59, 61, 81, 102, 127, 144, 165, 187, 217, 237, 246, 271 | |
| 20, 21, 60, 62, 100, 103, 128, 145, 166, 188, 218, 238, 247, 272 | |
| 4, 22, 51, 63, 99, 104, 129, 146, 167, 189, 219, 239, 248, 273 | |
| 5, 23, 52, 64, 98, 105, 130, 147, 168, 190, 220, 240, 249, 274 | |
| 6, 24, 53, 65, 97, 106, 131, 148, 169, 191, 211, 231, 250, 275 | |
| 7, 25, 54, 66, 90, 107, 132, 149, 170, 192, 212, 232, 251, 276 | |
| 8, 26, 55, 67, 95, 108, 133, 150, 171, 193, 213, 233, 252, 277 | |
| 9, 27, 56, 68, 94, 109, 134, 151, 172, 194, 214, 234, 253, 278 | |
| 10, 28, 57, 69, 93, 110, 135, 152, 173, 195, 215, 235, 254, 279 | |
| 11, 29, 58, 70, 92, 111, 136, 153, 174, 196, 216, 236, 255, 280 | |
| 12, 30, 59, 71, 91, 112, 137, 154, 175, 197, 217, 237, 256, 264 | |
| 13, 31, 60, 72, 90, 113, 138, 155, 176, 198, 218, 238, 257, 265 | |
| 14, 32, 41, 73, 89, 114, 139, 156, 177, 199, 219, 239, 258, 266 | |
| 15, 33, 42, 74, 88, 115, 140, 157, 178, 200, 220, 240, 259, 267 | |
| 16, 34, 43, 75, 87, 116, 131, 158, 179, 181, 201, 221, 260, 268 | |
| 17, 35, 44, 76, 86, 117, 132, 159, 180, 182, 202, 222, 241, 269 | |
| 18, 36, 45, 77, 85, 118, 133, 160, 161, 183, 203,223, 242, 270 | |
| 19, 37, 46, 78, 84, 119, 134, 141, 162, 184, 204, 224, 243, 261 | |
| 20, 38, 47, 79, 83, 120, 135, 142, 163, 185, 205, 225, 244, 262 | |
| 1, 39, 48, 80, 82, 110, 136, 143, 164, 186, 206, 225, 245, 263 | |
| 2, 40, 49, 61, 81, 111, 137, 144, 165, 187, 207, 227, 246, 271 | |
| 3, 24, 50, 62, 100, 112, 138, 145, 166, 188, 208, 228, 247, 272 | |
| 4, 25, 51, 63, 99, 113, 139, 146, 167, 189, 209, 229, 248, 273 | |
| 5, 26, 52, 64, 98, 114, 140, 147, 168, 190, 210, 230, 249, 274 |
Раздел 1
Моль. Количество вещества эквивалента
простых и сложных веществ. Закон эквивалентов
В химических расчетах наряду с массой и объемом используется понятие моль. Моль – количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода  C. Число структурных единиц, содержащихся в 1 моль вещества, определено с большой точностью; в практических расчетах его принимают равным 6,02×1023 моль-1 и называют постоянной Авогадро. Масса 1 моль вещества, выраженная в г/моль, называется молярной (мольной) массой. Она численно равна относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Так, относительная молекулярная масса кислорода O2 равна 32, а молярная масса составляет 32 г/моль.
C. Число структурных единиц, содержащихся в 1 моль вещества, определено с большой точностью; в практических расчетах его принимают равным 6,02×1023 моль-1 и называют постоянной Авогадро. Масса 1 моль вещества, выраженная в г/моль, называется молярной (мольной) массой. Она численно равна относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Так, относительная молекулярная масса кислорода O2 равна 32, а молярная масса составляет 32 г/моль.
Эквивалентом вещества называют реальную или условную частицу (УЧ), которая в кислотно-основных реакциях и реакциях ионного обмена может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равноценна) одному атому или иону водорода.
Например, в реакциях полной нейтрализации эквиваленты серной кислоты H2SO4 и ортофосфорной кислоты H3PO4, а также гидроксида кальция Ca(OH)2 и гидроксида алюминия Al(OH)3 соответственно равны 1/2 или 1/3 частицы Х:
Э (H2SO4)=1/2(H2SO4) и Э (H3PO4)=1/3(H3PO4); Э (Ca(OH)2)=1/2(Ca(OH)2) и Э (Al(OH)3)=1/3(Al(OH)3).
Число, равное той доле частицы Х, которая является эквивалентом вещества в данной реакции, называют фактором эквивалентности fэкв(Х), а величина, обратная фактору эквивалентности – эквивалентным числом ZB(Х).
В приведенных примерах:
f экв(H2SO4)=1/2, Z B(H2SO4)=2;
f экв(H3PO4)=1/3, Z B(H3PO4)=3;
f экв(Ca(OH)2)=1/2, Z B(Ca(OH)2)=2;
f экв(Al(OH)3)=1/3, Z B(Al(OH)3)=3.
В окислительно-восстановительных реакциях эквивалент вещества – это реальная или условная частица, эквивалентная одному электрону, который принимает окислитель или отдает восстановитель.
Так, перманганат калия KMnO4, являющийся окислителем, в нейтральной среде восстанавливается до MnO2, принимая 3 электрона:
MnO4- + 2H2O + 3e = MnO2 + 4OH-.
Таким образом, f экв(KMnO4)=1/3, Э (KMnO4)=1/3(KMnO4).
Количество вещества эквивалента n экв(Х) измеряется в моль и может быть рассчитано из соотношения:
n экв(Х)= n (Х)/ f экв(Х),
где n (Х) – количество вещества (молекул).
Молярная масса эквивалента (эквивалентная масса) M экв(Х) – это масса 1 моль эквивалента (г/моль). Она равна произведению фактора эквивалентности на молярную массу вещества или частному от деления молярной массы на эквивалентное число.
Например, молярная масса эквивалента серной кислоты M экв(H2SO4)=1/2 M (H2SO4)=98·1/2=49 г/моль.
Молярным объемом эквивалента газа (V экв) называется объем, который занимает при данных условиях 1 моль эквивалента вещества, находящегося в газообразном состоянии.
Как известно, 1 моль любого газа при нормальных условиях (T =273 K, P =101,3 кПа) занимает объем 22,4 л. Исходя из этой величины, можно рассчитать объем одного 1 моль эквивалента газа при н.у. (V экв).
Например, для водорода: Э (H2)=1/2(H2); 1 моль эквивалента водорода в 2 раза меньше 1 моль (молекул H2) и поэтому объем 1 моль эквивалента водорода в 2 раза меньше его молярного объема:
V экв(H2)=22,4/2=11,2 л/моль.
Для кислорода: Э (O2)=1/4(O2), отсюда объем одного 1 моль эквивалента кислорода в четыре раза меньше его молярного объема:
V экв(O2)=2 22,4/4=5,6 л/моль.
Согласно закону эквивалентов: массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов: m 1/ m 2= M экв1/ M экв2.
Поделив массу каждого вещества на молярную массу его эквивалента, получаем: m 1/ M экв1 = m 2/ M экв2, или n экв1= n экв2, т.е. количества (моль) эквивалентов, участвующих в реакции веществ, равны между собой.
Пример 1. Определите эквивалент (Э) и молярную массу эквивалента (М экв) азота, кислорода и хлора в соединениях NH3, H2O, HCl.
Решение: В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль атомов азота, 1/2 моль атомов кислорода, 1 моль атомов хлора. Отсюда:
Э (N)=1/3(N), Э (O)=1/2(O), Э (Cl)=1(Cl).
Исходя из молярных масс атомов элементов, определим молярные массы эквивалентов:
М экв(N)=14×1/3=4,67 г/моль, М экв(O)=16×1/2=8 г/моль,
М экв(Cl)=1×35,45 = 35,45 г/моль.
Ответ: М экв(N)=8 г/моль г/моль, М экв(Cl)=35,45 г/моль.
Пример 2.  В реакции между магнием и кислотой выделилось 0,183 мл водорода при 20 0С и 750 мм рт. ст. Определите молярную массу эквивалента магния.
В реакции между магнием и кислотой выделилось 0,183 мл водорода при 20 0С и 750 мм рт. ст. Определите молярную массу эквивалента магния. 
Решение: Расчет можно провести двумя методами.
Первый метод: по уравнению Менделеева-Клапейрона вычислим массу водорода, исходя из его объема:



 .
. 

Согласно закону эквивалентов: 

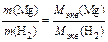 ; отсюда
; отсюда

Второй метод: объем водорода приводим к нормальным условиям:
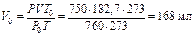 .
.
В пропорции, выражающей закон эквивалентов, заменяем массу водорода его объемом при нормальных условиях, а молярную массу эквивалента водорода – его эквивалентным объемом:
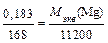 , отсюда
, отсюда

Ответ: М экв(Mg)=12,2 г/моль.
Пример 3.  Сколько граммов металла, молярная масса эквивалента которого 12,16 г/моль, взаимодействует с 310 мл кислорода (н.у.)?
Сколько граммов металла, молярная масса эквивалента которого 12,16 г/моль, взаимодействует с 310 мл кислорода (н.у.)?
Решение: Для кислорода молярная масса эквивалента равна:
М экв(O2)=32/4=8 г/моль,
молярный объем эквивалента составляет (н.у.):
 Vэкв =22,4/4=5,6 л/моль=5600 см3.
Vэкв =22,4/4=5,6 л/моль=5600 см3.
По закону эквивалентов:

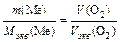 или
или  , откуда
, откуда  .
.
Ответ: m (Mе)=0,673 г.
Пример 4. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла.
Решение: При решении задачи следует иметь в виду, что молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей. В соответствии с законом эквивалентов и учитывая вышесказанное, составим уравнение для расчета Мэкв (Ме):
 или
или 
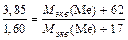 .
.
Отсюда M экв(Ме)=15 г/моль.
Задачи для самостоятельного решения
1. Что называют эквивалентом вещества? При каком условии эквивалент идентичен самой частице вещества Х? Покажите, какая условная частица (УЧ) является эквивалентом HNO3 в кислотно-основных реакциях и при взаимодействии разбавленного раствора кислоты с медью?
2. Что называют фактором эквивалентности? Чем определяется его значение для кислот, оснований, оксидов, солей? Поясните на примерах веществ: H2SO3, Mg(OH)2, Na2O, Ca3(PO4)2.
3. Что называют молярной массой эквивалента вещества? Чему равна эта величина а) для Ba(OH)2 и H3PO4 в реакциях полной нейтрализации; б) для элементов: хлора, серы, фосфора в их водородных соединениях?
4. Определите эквивалент вещества и молярную массу эквивалента для: а) H3PO4 в реакциях с NaOH, которые приводят к образованию NaH2PO4, Na2HPO4 или Na3PO4; б) Fe(OH)3 в реакциях с H2SO4, протекающих с образованием (Fe(OH)2)2SO4, FeOHSO4 или Fe2(SO4)3.
5. Что называют количеством вещества эквивалента? Чему равна эта величина для исходных веществ в реакциях:
a) Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O,
б) Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O,
в) AlCl3 + 3NH4OH = Al(OH)3 + 3NH4Cl?
6. Что понимают под эквивалентом вещества в окислительно- восстановительных реакциях? Поясните на примере реакции, предварительно подобрав коэффициенты:
KMnO4 + H2SO4 + Na2SO3 = MnSO4 + Na2SO4 + K2SO4 + H2O
Какая частица является эквивалентом окислителя и восстановителя?
7. Что называют молярным объемом эквивалента газа (эквивалентным объемом)? Покажите, чему равна эта величина для следующих газов при н.у.: N2, Cl2?
8. От чего зависит эквивалент атома химического элемента в соединении? Поясните на примере оксидов азота, в которых на два атома азота приходится: а) пять, б) четыре, в) три, г) один атом кислорода.
9. Молярная масса эквивалента трехвалентного металла равна 9 г/моль. Вычислите относительную атомную массу металла, а также молярную массу эквивалента его оксида и массовую долю кислорода в оксиде. (Ответ: 27; 17 г/моль)
10. Чему равна молярная масса эквивалента воды при взаимодействии ее а) с натрием, б) с оксидом натрия.
(Ответ: 18 г/моль)
11. При растворении в кислоте металла массой 11,9 г выделился водород объемом 2,24 л (н.у.). Чему равны фактор эквивалентности и молярная масса эквивалента для этого металла?
(Ответ: М экв=59,5 г/моль)
12. Металл массой 0,50 г вытеснил из раствора кислоты 198 мл водорода, собранного и измеренного при 25 0C и 745 мм рт. ст. Рассчитайте молярную массу эквивалента металла.
(Ответ: 32,7 г/моль)
13. Соединение мышьяка и серы содержит 39,0 % серы, молярная масса эквивалента которой 16 г/моль. Вычислите молярную массу эквивалента мышьяка. Определите валентность мышьяка. Составьте формулу соединения.
14. Рассчитайте молярные объемы эквивалента газообразных веществ (л/моль, н.у.) в следующих обменных реакциях, предварительно подобрав коэффициенты:
а) FeS + HCl = FeCl2 + H2S (г),
б) Ba(OH)2 + CO2 (г) = Ba(HCO3)2.
Рассчитайте количество вещества эквивалента (моль), содержащееся в 2,8 л (н.у.) каждого газа.
(Ответ: 11,2 л/моль; 0,25 моль)
15. Навеску алюминия массой 0,2046 г растворили в соляной кислоте. Выделившийся водород занял объем 274 мл при 19 0C и 755 мм рт.ст. Вычислите молярную массу эквивалента алюминия.
(Ответ: 9 г/моль)
16. При окислении 16,74 г двухвалентного металла образовалось 21,62 г оксида. Рассчитайте молярные массы эквивалентов металла и его оксида. Чему равна атомная масса металла?
(Ответ: 27,45 г/моль; 35,45 г/моль)
17. Одна и та же масса металла соединяется с 1,591 г галогена и с 70,2 см3 кислорода (н.у.). Вычислите молярную массу эквивалента галогена. (Ответ: 126,9 г/моль)
18. Рассчитайте молярную массу эквивалента цинка, зная, что 0,584 г его вытеснили из кислоты 2,19 мл водорода, измеренного при 17 0C и 740 мм рт.ст. (Ответ: 32,7 г/моль)
19. На полную нейтрализацию 0,943 г фосфористой кислоты H3PO3 израсходовано 1,291 г KOH. Вычислите молярную массу эквивалента кислоты и ее основность. (Ответ: М экв=41 г/моль)
20. Сульфид металла содержит 36,4 %(мас.) серы. Определите молярную массу эквивалента металла, зная, что молярная масса эквивалента серы равна 16 г/моль. (Ответ: 28 г/моль)
Раздел 2
Строение атома. Периодический закон,
периодическая система элементов Д.И. Менделеева
Электронное строение атома определяется, в первую очередь, энергией электронов и вероятностью их нахождения в каждой точке пространства вблизи ядра. Современная теория строения атома основана на законах квантовой механики.
Во-первых, в квантовой механике энергия электромагнитного излучения (в том числе и электронов) изменяется не непрерывно, а порциями – квантами. Изменение энергии электрона от E 1 до E 2 сопровождается поглощением света с частотой (ν), определяемой уравнением Планка:
E 1 - E 2 = hν.
Во-вторых, все микрочастицы обладают свойствами как частицы, так и волны (корпускулярно-волновой дуализм). Масса любой частицы (m) и ее скорость связаны с длиной волны (λ) уравнением де Бройля:
λ=h/mv,
где h – постоянная Планка.
В-третьих, невозможно одновременно точно определить координату (положение) и импульс микрочастицы, включая электрон (принцип неопределенности Гейзенберга). Погрешности в определении координаты (Δ x) и импульса (Δ p = m Δ v) связаны соотношением:
Δ x ∙Δ p ≥ h /2 π.
В квантовой механике оперируют понятием вероятности нахождения электрона в данной точке пространства (d V).
Приведенные положения показывают, что движение электрона в атоме нельзя рассматривать как обычное перемещение, привычное в рамках классической механики. Квантовая механика описывает движение электрона в атоме с помощью волновой функции Ψ (пси), которая является функцией координат x, y, z и не зависит от времени. Квадрат волновой функции Ψ 2 пропорционален вероятности нахождения электрона в некотором объёме, окружающем точку с координатами x, y, z. Фундаментальным уравнением квантовой механики является уравнение Шредингера, связывающее функцию Ψ (x,y,z) с полной энергией электрона (E), равной сумме потенциальной и кинетической энергии:
ĤΨ = EΨ,
где Ĥ – оператор полной энергии, указывающий определенную последовательность математических действий над функцией Ψ.
Уравнение Шредингера точно решено только для атома водорода и водородоподобных атомов, т.е. для случая одного электрона, находящегося в сферическом поле ядра. Решение уравнения для одноэлектронной системы позволяет найти волновые функции Ψ (x,y,z). При этом выяснено, что для полного определения каждого решения необходимы три целых числа. Эти числа называют квантовыми и обозначают n, l, m.
Совокупность мест пространства, где квадрат волновой функции имеет максимальное значение, называется атомной орбиталью (АО) или электронным облаком. Каждой атомной орбитали соответствует область пространства определенного размера, формы и ориентации, равноценная понятию электронного облака.
Главное квантовое число – n определяет общую энергию электрона на данной орбитали. Это число может принимать любые целочисленные положительные значения: n= 1, 2, 3, …, ∞. Чем выше значение n, тем больше размер атомной орбитали, на которой движется электрон. Орбитали с одинаковыми значениям n образуют энергетические уровни или электронные слои.
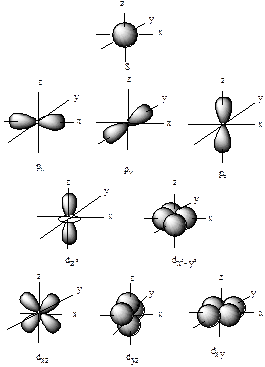 |
Орбитальное или побочное квантовое число – l характеризует различные энергетические состояния электрона в пределах данного уровня. Число l может принимать целочисленные значения: l= 0, 1, 2,…, (n- 1). Величина l определяет форму атомной орбитали. При l= 0 орбиталь имеет сферическую форму и назывется s -орбиталью. При l= 1 орбиталь имеет форму гантели и называется p -орбиталью. При l= 2 форма орбитали четырехлепестковая и назывется d - орбиталью (рис. 1). Орбитали с одинаковыми значениям n и l называют подуровнем.
Рис. 1. Формы s -, p - и d -электронных облаков (орбиталей)
Магнитное квантовое число – m зависит от орбитального квантового числа l и может принимать целочисленные значения:
m =– l, 0, +l. Значение m определяет ориентациюэлектронного облака относительно произвольно выбранных направлений взаимно перпендикулярных осей (x, y, z) или относительно внешнего магнитного поля. Число возможных значений m равно числу орбиталей в данном подуровне. Например, при: n= 2 подуровню l= 1 соответствуют орбитали 2 p x (m= +1), 2 p y (m= 0), 2 p z (m= -1). При n= 2 подуровню l= 2 отвечают пять орбиталей разных ориентаций (рис. 1).
Таблица 1
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1368; Нарушение авторских прав?; Мы поможем в написании вашей работы!