
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Наиболее распространённые геометрические формы молекул
|
|
|
|
| Число электронных пар | Тип гибриди-зации | Расположение электронных пар центр. атома | Геометрическая форма и состав молекулы | При-меры | |
| связы-вающих (пп) | несвязывающих (нп) | ||||
| sp | Линейное | Линейная АВ 2 | CO2, BeCl2 | ||
| sp 2 | Треугольное | Плоский треугольник АВ 3 | AlCl3, CO32- | ||
| Угловая АВ 2 | SO2, GeF2 | ||||
| sp 3 | Тетраэдрическое | Тетраэдр АВ 4 | CH4, ClO4-, | ||
| Тригональ-ная пирамида АВ 3 | NH3, PF3, | ||||
| Угловая АВ 2 | H2O, H2S, | ||||
| sp 3 d | Тригонально-бипирами-дальное | Тригональная бипирамида АВ 5 | PCl5, PF5 | ||
| sp 3 d 2 | Октаэдричес-кое | Октаэдр АВ 6 | SF6, [SiF6] |
Присутствие в молекуле неподеленных электронных пар сказывается на величине валентных углов. Так, в молекулах аммиака и воды имеет место одинаковый тип гибридизации атомных орбиталей центральных атомов – sp 3, но валентные углы различаются. Это связано с тем, что силы расталкивания между неподеленными электронными парами больше, чем между поделёнными парами (пп).
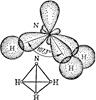
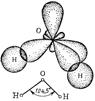
а б
Рис. 7. Схемы образования молекул NH3 (а) и H2O (б).
Пример 2. Опишите пространственную структуру молекул:
а) CO2; б) SO2; в) SiF4.
Решение:
а) Графическая формула молекулы CO2 имеет вид:  O=C=O. Атом углерода образует четыре связи, две из них – σ -связи.
O=C=O. Атом углерода образует четыре связи, две из них – σ -связи.
Строение валентного уровня атома углерода соответствует формуле: 2 s 22 p 2. Для образования четырех ковалентных связей атом углерода при взаимодействии с кислородом переходит в возбужденное состояние, которое сопровождается переходом одного из 2 s -электронов на свободную 2 p -орбиталь:
C:
Образование двух равноценных σ -связей объясняется гибридизацией одной s - и одной p -орбитали, в результате которой получается две одинаковые sp -гибридные АО.

Оставшиеся две 2 p -орбитали участвуют в образовании π-связей. Таким образом, молекула CO2 имеет линейное строение.
б) Изобразим графическую формулу молекулы SO2: O=S=O.
Атом серы образует четыре ковалентных связи, две из них – σ - и две π -связи. Для их образования требуется переход атома серы в возбуждённое состояние, при котором происходит распаривание 3 p -электронной пары на свободную 3 d -орбиталь.
В электронографической формуле атома серы выделим электроны, образующие σ -связи (т.е. поделённые электронные пары) и определим число неподелённых электронных пар.
1нп+2пп <OSO~119,50
В пространстве вокруг атома серы необходимо разместить три электронные пары: одну неподеленную и две σ -связывающие (π-связывающие орбитали не рассматриваются). Для этого требуется три гибридных атомных орбитали. Таким образом, в гибридизации будут участвовать одна s - и две p -орбитали, тип гибридизации – sp 2.
Следует иметь в виду, что расположение в пространстве σ-связывающих и неподеленных электронных пар, как правило, не соответствует форме молекул. Форма молекул определяется расположением ядер атомов. Следовательно, молекула SO2 имеет угловую форму.
в) Графическая формула, расположение σ-связей атома кремния с атомами фтора в молекуле SiF4 имеют вид:
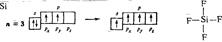
4пп (4 σ-связи)
Для образования четырех ковалентных связей атом кремния переходит в возбужденное состояние, при котором один из 3s-электронов промотирует на свободную 3 p -орбиталь. В гибридизации участвуют одна s - и три p -орбитали, тип гибридизации – sp 3. Четыре гибридных АО располагаются в пространстве по направлению к вершинам правильного тетраэдра под углом 109,5° друг к другу. Следовательно, молекула SiF4 имеет форму тетраэдра.
Наиболее универсальным методом описания ковалентной связи является метод молекулярных орбиталей. Он применим для веществ с любым типом химической связи за исключением слабых межмолекулярных взаимодействий. На качественном уровне этот метод достаточно прост. Основная идея метода молекулярных орбиталей (ММО) заключается в том, что все электроны находятся на молекулярных орбиталях, единых для всей системы ядер и электронов данной молекулы. Для определения волновых функций молекулярных орбиталей используют приближение, называемое линейной комбинацией атомных орбиталей (ЛКАО): молекулярная волновая функция (МО) получается простым сложением или вычитанием атомных волновых функций (АО). Основные положения метода МО ЛКАО (метода молекулярных орбиталей в предположении линейной комбинации атомных орбиталей) заключаются в следующем:
В образовании МО могут участвовать АО, имеющие сходную симметрию и близкую энергию.
Количество МО в молекуле равно сумме АО атомов, входящих в её состав.
МО, которая получается при сложении АО, имеет более низкую энергию, чем исходные АО, и называется связывающей, а при вычитании АО – более высокую энергию и называется разрыхляющей. При этом у гомоядерных молекул число связывающих и разрыхляющих МО одинаково.
При заполнении МО электронами выполняются принцип наименьшей энергии, принцип Паули и правило Хунда.
Электронные облака молекулярных орбиталей двухатомных молекул по аналогии с атомными орбиталями обозначают греческими буквами σ, π и δ.
Электронное строение молекулы изображают в виде энергетической диаграммы.
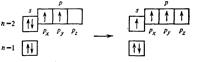
Рассмотрим принципы построения диаграмм МО гомоядерных двухатомных молекул, образованных атомами элементов I и II периодов периодической системы элементов.
Простейшей является молекула водорода H2. При образовании молекулы Н2 из двух 1 s - АО образуется две МО: одна связывающая (σ 1s) и одна разрыхляющая (σ 1s*). Соотношение между энергиями АО и МО отражено на энергетической диаграмме, где каждая атомная или молекулярная орбиталь изображена горизонтальной чертой. Уровень расположения черты соответствует относительной энергии орбитали. МО расположены в средней части диаграммы, АО – по ее краям. Электроны обозначают стрелками, направление которых соответствует спину электрона.
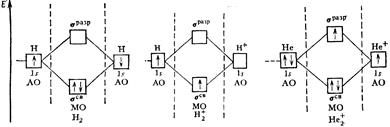
Рис. 8. Энергетические диаграммы двухатомных молекул, образованных элементами первого периода
Энергия связи коррелирует с величиной кратности или порядка связи (ρ), вычисляемой как полуразность числа электронов на связывающих и разрыхляющих орбиталях:
ρ =(∑ связ. е – ∑ разрых.е)/2.
Если ρ =0, то молекула не образуется. Порядок связи может принимать как целые, так и дробные положительные значения.
Е связи, кДж/моль
ρ (Н2+) = (1 - 0)/2=0,5 256
ρ (Н2) = (2 - 0)/2=1 432
ρ (Не2+) = (2 - 1)/2=0,5 250
Таким образом, энергия связи в молекуле Н2 больше, чем в ионе Н2+. Молекула Не2 существовать не может, так как число связывающих и разрыхляющих электронов в ней одинаково и порядок связи равен нулю.
Двухатомные молекулы элементов II периода.
Атомы элементов этого периода имеют заполненный первый уровень и частично или полностью заполненный 2-ой (валентный) уровень. Орбитали заполненного слоя, как правило, не принимают участия в в образовании связи, так как число электронов на образующихся СМО и РМО одинаково. Они составляют остов молекулы. МО образуются при линейной комбинации 2 s - и 2 р - орбиталей. На рис. 9 представлены диаграммы МО молекул N2 и O2.
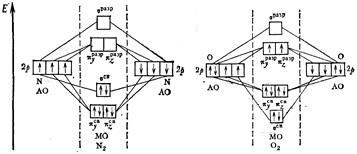
Рис. 9. Энергетические диаграммы молекул N2 и O2.
В молекуле О2 8 электронов (2 р -подуровней) заселяют сначала σ 2р-, а затем π 2р- и π 2р*-молекулярные орбитали. На каждой из π 2р*-МО в соответствии с правилом Хунда находится по 1е-. Отсюда следует, что молекула О2 – парамагнитна, так как имеет два неспаренных электрона. Порядок связи в молекуле О2 равен 2, энергия связи составляет 498 кДж/моль, длина связи – 1,21 Å.
Экспериментально доказано, что в молекулах от Li2 до N2 π 2р-СМО лежат ниже, чем σ 2р-СМО. На разрыхляющих орбиталях данных молекул электроны отсутствуют, поэтому связи более прочные и короткие.
В молекуле N2, в отличие от молекулы О2, 6 электронов (2 р -подуровней) заселяют сначала две π 2р-СМО, а затем σ 2р-МО, на π 2р*-МО электронов нет. Порядок связи в молекуле N2 равен 3, энергия связи составляет 945 кДж/моль, длина связи – 1,10 Å.
Какую информацию о строении и свойствах молекул можно извлечь из энергетических диаграмм МО?
Прочность молекул (энергия диссоциации) коррелирует со значением порядка связи. Молекула N2 значительно прочнее молекулы О2.
Длина связи (межатомные расстояния) также коррелирует со значением порядка связи. Так, молекула N2 значительно прочнее молекулы О2, соответственно длина связи N-N меньше, чем O-O.
Магнитные свойства молекулярных частиц определяется так же, как и для атомов: частицы, имеющие неспаренные электроны, парамагнитны (втягиваются во внешнее магнитное поле) и диамагнитны (выталкиваются из магнитного поля), если все электроны спарены. Следовательно, ион Н2+ и молекула О2 – парамагнитны, а молекулы Н2 и N2 – диамагнитны.
Ионная связь. При взаимодействиинаиболее электроотрицательных атомов с наиболее электроположительными (например, щелочных металлов и галогенов) образуется связь с большой степенью полярности. Поскольку электроотрицательности этих атомов различаются очень сильно, при сближении атомов валентные электроны одного из них полностью переходят ко второму атому. В результате оба атома становятся ионами:
Na · + · Cl → [Na: Cl] → [Na+][Cl-]
Между ионами Na+ и Cl- возникает электростатическое притяжение. Такую связь называют ионной.
Чисто ионных связей нет. В реальных молекулах связи носят промежуточный характер между ионными и ковалентными
Ионная связь может быть описана в рамках методов ВС и МО, однако обычно её рассматривают с помощью законов электростатики.
При обычных условиях ионные соединения существуют в твёрдом состоянии. Кристалл ионного соединения состоит из закономерно расположенных положительно и отрицательно заряженных ионов. Все связи данного иона с другими энергетически равноценны. При растворении или плавлении ионного кристалла в раствор переходят заряженные ионы.
В отличие от ковалентной связи ионная связь ненаправлена и ненасыщаема. Это объясняется тем, что электрическое поле ионов имеет сферическую симметрию. Ионы противоположного знака притягиваются друг к другу независимо от их расположения в пространстве, при этом полной взаимной компенсации электрических полей ионов не происходит. Каждый ион имеет возможность взаимодействовать с переменным и большим числом противоположно заряженных ионов. Координационные числа (кч) ионов в ионных соединениях имеют большие значения. В отличие от ковалентных соединений кч определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов.
Ионные связи обладают большой прочностью, поэтому ионные кристаллы имеют:
а) высокую прочность, твердость, хрупкость;
б) высокие температуры плавления;
в) компактную структуру (плавятся с увеличением объема);
г) твердые ионные кристаллы являются изоляторами, так как в узлах кристаллической решетки находятся ионы противоположного знака;
д) хорошую растворимость в полярных растворителях (“подобное растворяется в подобном”).
Электростатическое взаимодействие ионов в ионном соединении приводит к взаимной деформации их электронных оболочек, которую называют поляризацией. Процесс поляризации двусторонний, в нем сочетается пояризующее действие и поляризуемость.
Если изолированные ионы могут сохранять сферическую форму (рис. 10а), то в результате поляризации происходит изменение формы облаков (рис. 10б), приводящее к уменьшению степени ионности связи (связь становится частично ковалентной).
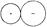

а б
Увеличение поляризации
Рис. 10. Поляризация катиона анионом
Это отражается на свойствах веществ с ионным типом связи: уменьшает их растворимость, термическую устойчивость, приводит к появлению окраски.
Металлическая связь. Атомы металлов содержат на внешних уровнях мало электронов и, следовательно, имеют много вакантных атомных орбиталей. Образование атомом возможно большего числа химических связей способствует понижению внутренней энергии - его химическому насыщению. Атомы металлов могут достичь этого при плотной упаковке в кристаллические структуры, в которых малочисленные валентные электроны каждого атома смогут принадлежать одновременно нескольким атомам, образуя между ними нелокализованные связи.
При одновременном взаимодействии N атомов в кристалле число возникающих молекулярных орбиталей равно сумме орбиталей отдельных атомов. Даже если учитывать только внешние s - и р -орбитали, то при содержании в кристалле N атомов образуется 4 N молекулярных орбиталей (рис. 11). Число электронов, занимающих эти МО в порядке возрастания соответствующей им энергии, мало. Так, атом лития имеет один валентный электрон на 2 s -орбитали. При взаимодействии N атомов лития 2 s -АО, на которых находятся валентные электроны, образуют валентную зону, состоящую из N σ -МО. Нижняя часть валентной зоны, включающая σ-связывающие МО, заполнена электронами. Верхняя часть валентной зоны, образованная σ *-разрыхляющими МО, свободна и называется зоной проводимости.

Рис. 11. Расщепление энергетических уровней электронов
при последовательном присоединении атомов
При наложении даже незначительной разности потенциалов электроны, благодаря близости энергетических уровней, способны переходить из валентной зоны в зону проводимости, перенося электрические заряды через весь кристалл. Таким образом, у металлов валентная зона сливается с зоной проводимости.
В атомах неметаллов число валентных электронов велико и валентная зона кристалла практически заполнена электронами. Зона проводимости образуется за счет орбиталей, имеющих намного большую энергию, чем валентные орбитали, т.е. принадлежащих следующему электронному уровню. В таких кристаллах между валентной зоной и зоной проводимости находится запрещенная зона. Если валентная зона полностью занята электронами, вещества не обладают металлической проводимостью. Их электрофизические свойства зависят от ширины запрещенной зоны.
В кристалле алмаза валентная зона заполнена электронами, ширина запрещенной зоны Δ Е =5,7 эВ. Электроны не могут перейти в зону проводимости без разрыва химических связей, т. е. без разрушения кристалла. В связи с этим алмаз является диэлектриком, так как не способен проводить электрический ток.
Кристаллы кремния имеют структуру алмаза, но атомы Si обладают свободными 3 d -орбиталями, близкими по энергии к 3 р -орбиталям. Поэтому зона проводимости, образуемая 3 d -АО, располагается ближе к валентной зоне, Δ Е составляет только 1,12 эВ и валентные электроны при небольшом возбуждении могут переходить в зону проводимости. В результате кристалл кремния способен проводить электрический ток.
Подобные материалы, которые в нормальном состоянии являются диэлектриками, а в возбужденном (под действием теплоты или света) – проводниками электричества, называют полупроводниками. У полупроводников ширина запрещенной зоны Δ Е составляет 0,1 – 3 эВ.
Различия в зонной структуре металлов (а), полупроводников (б) и диэлектриков (в) показаны на рис. 12.
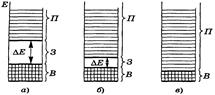
Рис. 12. Относительные размеры энергетических зон:
В – валентной, З – запрещенной, П – проводимости – для кристаллов:
а – диэлектриков, б - полупроводников, в – металлов.
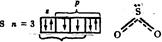
Водородная связь образуется между положительно поляризованным атомом водорода одной молекулы и сильно электроотрицательным атомом (F, O, N, реже – Cl и S), принадлежащим той же или другой молекуле. Такую связь может образовывать только атом водорода, связанный с электроотрицательным атомом, смещающим на себя электронную плотность и создающим тем самым на атоме водорода эффективный положительный заряд (+ δ). Например, в молекуле спирта водородную связь с другими молекулами может осуществлять только атом водорода, связанный с кислородом:
CH3-CH2-O-δ←H+δ (стрелка указывает направление смещения пары электронов).
Водородную связь (Н-связь) обозначают тремя точками (…):
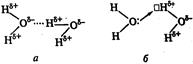
Рис. 13. Схема образования водородной связи
Водородная связь является, с одной стороны, результатом диполь-дипольного взаимодействия (рис. 13 а). С другой стороны, в образовании водородной связи существенную роль играют донорно-акцепторные взаимодействия. Положительно поляризованный атом водорода, практически лишенный электронной оболочки, так как в его связях электронная плотность смещена в сторону более электроотрицательного атома, может являться акцептором электронной пары (рис. 13 б).
По энергии водородная связь не очень прочная (от 4 до 20 кДж/моль), но в некоторых случаях, например, в H2F2, её энергия близка к энергии ковалентной связи (~200 кДж/моль).
Сильные водородные связи возникают в воде. Многие удивительные свойства воды обусловлены наличием таких связей. Например, плотность льда меньше плотности жидкой воды, поскольку молекулы воды во льду связаны с четырьмя другими молекулами водородными связями, образуя трехмерную решетку, в которой существуют пустоты. При плавлении льда часть водородных связей разрушается, молекулы сближаются, и плотность воды увеличивается. Однако при температуре, близкой к температуре плавления (0 0С), не все водородные связи в структуре льда рвутся. В жидкой воде сохраняются большие фрагменты льда. Часть молекул, не вошедших в структуру льда, помещается в его пустотах, и это приводит к повышению плотности жидкости по сравнению с плотностью кристалла. Наибольшую плотность вода имеет при 4 0С. Система водородных связей сохраняется в жидкой воде и при дальнейшем нагревании вплоть до температуры кипения. Лишь в газовой фазе вода практически неассоциирована. Этим объясняется высокая температура кипения воды.
Наличие водородной связи оказывает значительное влияние на многие физико-химические свойства веществ, в том числе:
· повышает температуру кипения веществ;
· увеличивает их растворимость в воде за счет образования водородной связи между молекулами воды и растворённых веществ, например, NH3, спирты и др.;
· способствует ориентации полимерных молекул, например, с помощью водородной связи между нуклеиновыми основаниями (N-H…N и N-H…O) соединены цепи нуклеиновых кислот, образующие двойную спираль.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 6947; Нарушение авторских прав?; Мы поможем в написании вашей работы!