
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конденсированное состояние вещества
|
|
|
|
Химическая связь и строение молекул.
Свободные атомы большинства элементов стремятся объединиться, образуя системы с более низкой энергией – молекулы, цепи, слои, каркасы. Большинство веществ в газообразном состоянии состоят из молекул, образованных двумя и более атомами. Исключением являются благородные газы, молекулы которых одноатомны. Связь между атомами называют химической связью. Она имеет электростатическую природу, т.е. основана на электростатическом взаимодействии всех ядер и электронов, принадлежащих молекуле.
Описание химической связи в любой молекуле есть, по существу, описание распределения в ней электронной плотности. По характеру этого распределения принято различать ионный, ковалентный и металлический тип связи.
Ковалентную связь образуют атомы, не сильно отличающиеся по электроотрицательности. Химическая связь осуществляется за счёт обобществления электронов, принадлежащих взаимодействующим атомам. Электронная плотность сосредоточена в пространстве между ядрами атомов (H2, N2 и т.д.).
Ионная связь возникает в результате электростатического взаимодействия противоположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками (Na+Cl-, Cs+F- и т.д.).
Чисто ионные и чисто ковалентные связи представляют собой лишь предельные случаи химической связи. В подавляющем большинстве молекул химические связи являются промежуточными между чисто ионными и чисто ковалентными. Это полярные ковалентные связи, при которых общая электронная плотность смещена к ядру более электроотрицательного атома-партнера. Если такое смещение невелико, то связь по своему характеру приближается к чисто ковалентной; чем это смещение больше, тем ближе связь к чисто ионной.
При сближении молекул также возникает химическая связь. Межмолекулярные связи отличаются от межатомных значительно меньшей прочностью.
К числу фундаментальных характеристик молекулы относятся её геометрическое строение и прочность. Геометрическое строение молекулы определяется межъядерными расстояниями (длиной связи) и валентными углами (углами, образованными прямыми, проходящими через ядра химически связанных атомов). Прочность молекулы характеризуется энергией связи.
Для квантовомеханического описания ковалентной связи существуют два основных метода: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Основные положения метода валентных связей:
1. Ковалентная связь образуется двумя электронами, обладающими противоположно направленными спинами, принадлежащими двум атомам, между которыми осуществляется химическая связь.
Общая электронная пара может образоваться как в результате обобществления двух неспаренных электронов, принадлежащих разным атомам (обменный механизм образования связи), так и за счёт пары электронов одного атома – донора – и вакантной орбитали второго атома – акцептора (донорно-акцепторный механизм).
2. При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов: чем больше степень перекрывания, тем прочнее связь. Поэтому ковалентная связь образуется в том направлении, в котором достигается максимальное перекрывание.
Таким образом, МВС рассматривает ковалентную связь как двухэлектронную и двухцентровую связь, локализованную между двумя атомами.
Во многих случаях число неспаренных электронов в атоме оказывается меньшим, чем число образованных им связей. Это объясняется тем, что при возбуждении атома происходит распаривание одной или нескольких электронных пар внешнего (валентного) уровня с переходом одного электрона от каждой пары на свободную и энергетически доступную орбиталь более высокого подуровня. Такой процесс называется промотированием и требует затрат энергии (Е пром.). Промотирование электронов возможно при условии, что Е пром. не превышает той энергии, которая выделяется при образовании связей возбуждённым атомом. Например, промотирование электрона с 2 s - на 2 p -АО в атоме Be (1 s 22 s 2→1 s 22 s 12 p 1) требует затрат энергии, равной 264 кДж/моль. Однако при образовании двух связей возбуждённым атомом выделяется 922 кДж/моль, что с большим избытком компенсирует энергию промотирования и делает этот процесс энергетически выгодным. Наоборот, для атомов фтора, неона и гелия промотирование электронов невозможно, так как для этого могут быть использованы только орбитали следующего энергетического уровня. Это требует затраты энергии, лежащей за пределами возможных значений энергии связи и оценивается соответственно в 1257, 1605 и 1876 кДж/моль. В результате атом фтора образует только одну связь за счёт одного неспаренного электрона (1 s 22 s 22 p 5), а неон и гелий, в атомах которых отсутствуют неспаренные электроны, химических связей не образуют.
Свойства ковалентной связи: насыщаемость, направленность и полярность.
Насыщаемость ковалентной связи обусловлена способностью атомов к образованию строго ограниченного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут принимать участие в образовании химических связей, определяет максимально возможную ковалентность атома. Реальная ковалентность атома элемента в данном соединении определяется числом орбиталей, использованных для образования связей.
Если атом образует все связи только за счёт спаривания электронов (обменный механизм), то обычно говорят о его валентности (или спиновой валентности). Она определяется числом неспаренных электронов атома в основном или возбуждённом состояниях. Общее число связей, образованных атомом как по обменному, так и по донорно-акцепторному механизму, характеризует ковалентность атома.
Пример 1. Поясните, какие значения валентности и ковалентности могут иметь атомы азота и фосфора в соединениях?
Решение: Азот является элементом II периода. Валентный уровень его атома имеет 4 орбитали и 5 электронов:

На валентном уровне атома азота отсутствуют вакантные орбитали, следовательно, промотирование электрона с 2 s -подуровня невозможно. Атом азота образует три ковалентные связи по обменному механизму, проявляя валентность, равную трем. Одна ковалентная связь может быть образована по донорно-акцепторному механизму. Таким образом, ковалентность азота равна 4.
Например, в катионе аммония три связи N-H возникают в результате перекрывания одноэлектронных облаков атомов азота и водорода, а четвертая – за счет донорной 2 s -орбитали атома азота и пустой орбитали иона H+.
Сера является элементом III периода. Валентный уровень атома серы состоит из трех подуровней и 9 орбиталей. Атом серы может иметь два возбужденных состояния:
Невозбужденное состояние: валентность=2.
Возбуждённое состояние 1: валентность=4.
Возбуждённое состояние 2: валентность=6.
Наличие 9 валентных орбиталей в электронной оболочке атома серы предполагает его высокую ковалентность. Однако небольшие размеры атома серы не позволяют образовать более 6 ковалентных связей с соседями.
Максимальная ковалентность связана в большей степени с номером периода периодической системы, в котором находится элемент. У элементов I периода имеется одна валентная атомная орбиталь (1 s), поэтому ковалентность атома водорода должна быть равна единице (H-H). Однако, ковалентность атома водорода может быть увеличена до двух за счёт его способности образовывать водородные связи (H-F…H-F). Элементы II периода имеют только 4 валентных атомных орбитали (одна 2 s - и три 2 p -), поэтому их максимальная ковалентность равна 4. У атомов элементов III периода, имеющих 9 валентных орбиталей (одна 3 s -, три 3 p - и пять 3 d -АО), максимальная ковалентность меньше 9, что объясняется небольшими размерами атомов.
Направленность связи. Ковалентная связь возникает при перекрывании атомных орбиталей, а они строго направлены в пространстве, поэтому ковалентные связи также имеют вполне определённое направление, именно то, которое обеспечивает максимальную степень перекрывания электронных облаков.
Для s -электронных облаков, имеющих сферическую симметрию, все направления взаимодействия равноценны. Для p - и d -электронных облаков перекрывание возможно лишь вдоль оси, по которой они вытянуты, образующаяся при этом связь называется σ -связью.
σ -Связь имеет осевую симметрию, оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.

После образования между двумя атомами σ -связи для остальных электронных облаков остается возможность бокового перекрывания, по обе стороны от линии связи. В результате образуется π -связь.
Таким образом, одинарные связи являются σ -связями. Если между двумя атомами возникает кратная (двойная, тройная) связь, то только одна из них является σ -связью. Например, молекула азота:

Рис. 2. σ- и π-связи в молекуле азота
Число σ -связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него координационное число (кч). Например, в молекуле SO3 и ионе SO42- для атома серы оно соответственно равно трём и четырём.
Образование σ -связей фиксирует пространственное положение атомов относительно друг друга. Число σ -связей и углы между связями (валентные углы) определяют пространственную геометрическую конфигурацию ковалентных молекул и комплексных ионов. На величину валентных углов, а значит и на пространственную конфигурацию молекул, оказывают влияние и неподелённые электронные пары. Считается, что π -связь влияет только на длину и энергию связи.
Существует несколько способов определения геометрической формы молекул или, другими словами, направленности ковалентных связей.
Например, молекула сероводорода H2S – нелинейная, так как связь образована двумя p-орбиталями атома серы, находящимися под углом 900:
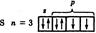

а б
Рис. 3. Схема образования молекулы H2S
Каждая p -орбиталь образует σ -связь с 1 s -орбиталью атома водорода (а), ядра атомов серы и водорода расположены под углом 920 (б). Следовательно, форма молекулы H2S – угловая.
Однако геометрическая форма многих молекул и ионов не может быть описана с помощью атомных s -, p - и d -орбиталей. Это бывает тогда, когда σ -связи образуются разными по симметрии орбиталями центрального атома, например, s - и p - или s -, p - и d -орбиталями. В таких случаях для описания пространственной формы молекул используется представление о гибридизации атомных орбиталей центрального атома. Согласно этому представлению, образованию химических связей предшествует изменение формы, а значит и энергии валентных атомных орбиталей атома: исходные неравноценные атомные орбитали, как бы “перемешиваясь”, образуют энергетически равноценные орбитали. При этом происходит перераспределение электронной плотности, которое требует затраты энергии и в изолированных атомах не реализуется. В результате гибридизации электронное облако центрального атома вытягивается по направлению к взаимодействующему с ним атому, благодаря чему увеличивается область перекрывания облаков. Это приводит к образованию более прочной химической связи и, следовательно, к выделению дополнительной энергии, которая и компенсирует затраты энергии на гибридизацию.
Число гибридных АО равно числу участвующих в гибридизации исходных АО атома. Если в гибридизации участвуют одна s - и одна p -орбиталь (sp -гибридизация), то образуются две равноценные sp -орбитали: из одной s - и двух p -орбиталей (sp 2-гибридизация) образуются три sp 2- орбитали; из одной s - и трёх p -орбиталей (sp 3-гибридизация) образуются три sp 3- орбитали и т.д.
Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодействие между электронами было минимальным, т.е. как можно дальше друг от друга. Поэтому при sp -гибридизации наиболее энергетически выгодным будет положение АО вдоль одной прямой в противоположных направлениях. Это определяет линейную конфигурацию соответствующих молекул, например, BeF2, BeCl2:
Be 1 s 22 s 2 Be* 1 s 22 s 12 px 1


(s+p)-орбитали две sp -орбитали
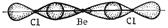
Рис. 4. Схема образования молекулы BeCl2.
При sp 2-гибридизации гибридные облака находятся в одной плоскости и направлены от центра к вершинам правильного треугольника (рис. 5). Валентный угол в этом случае равен 1200. Такой тип гибридизации осуществляется в молекулах BF3, BCl3.

(s+p+p)-орбитали три sp2 -орбитали

Рис. 5. Схема образования молекулы BCl3.
В случае sp 3-гибридизации четыре гибридных орбитали направлены к вершинам правильного тетраэдра под углом 109028′ (рис. 6). Примером тетраэдрических молекул являются CH4, CCl4, ион NH4+.
C: 1s22s22p2 C*: 1s22s12p1x2p1y2p1z
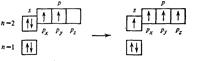
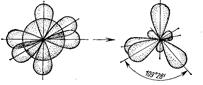
(s+p+p+p)-орбитали четыре sp3 -орбитали

Рис. 6. Схема образования молекулы CH4.
Если кроме s - и p -орбиталей в гибридизации участвуют, например, две d -орбитали (sp 3 d 2-гибридизация), то образовавшиеся шесть гибридных атомных орбиталей направлены к вершинам октаэдра (т.е. расположены по взаимно перпендикулярным направлениям).
В гибридизации могут участвовать не только орбитали с одним электроном и образующие σ -связи, но и АО с двумя электронами, не принимающие участия в образовании связи. В этом случае на гибридных орбиталях остаётся такое же число неподелённых (нп) электронных пар, которое было на исходных АО. Так, в молекуле SO2 у атома серы в гибридизации могут участвовать две p -орбитали, использованные на образование σ -связи, и одна s -орбиталь, имеющая неподеленную (нп) пару электронов. Следовательно, атом серы находится в состоянии sp 2-гибридизации и валентный угол OSO близок к 1200.
Геометрическая конфигурация молекул полностью определяется типом гибридизации орбиталей центрального атома только при условии, что все гибридные АО принимают участие в образовании связй. Если на валентном уровне центрального атома остаются электронные пары, не участвующие в образовании связей (нп), то они могут располагаться на гибридных орбиталях. В этом случае при одном и том же типе гибридизации возможны различные геометрические формы молекул (табл. 3).
Таблица 3
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 894; Нарушение авторских прав?; Мы поможем в написании вашей работы!