
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы молекулярно-кинетической теории
|
|
|
|
Молекулярная физика и термодинамика
Молекулярная физика изучает строение и свойства вещества исходя из того, что любое тело – твердое, жидкое или газообразное – состоит из большого числа малых обособленных частиц – атомов или молекул.
Свойства тел, которые наблюдаются на опыте: температура, давление, объем объясняются как суммарный результат действия частиц.
Экспериментальным обоснованием молекулярно-кинетической теории является: а) броуновское движение;
б) диффузия; в) теплопроводность.
Эти явления можно объяснить только исходя из того, что вещества состоят из большого числа малых частиц, которые находятся в непрерывном хаотическом тепловом движении.
1) Закон А. Авогадро.
Отношение плотностей газов ρ1 и ρ2 при одинаковых условиях:  .
.
здесь  и
и 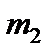 – массы молекул газов.
– массы молекул газов.
С другой стороны для одинаковых объемов:
 ,
,
здесь  и
и 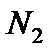 – число частиц газов
– число частиц газов
Из этих уравнений следует, что 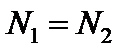 , т.е. при одинаковом давлении и температуре равные объёмы разных газов содержат одинаковое число частиц – это закон Авогадро.
, т.е. при одинаковом давлении и температуре равные объёмы разных газов содержат одинаковое число частиц – это закон Авогадро.
2) Закон Д. Дальтона. Закон Авогадро устанавливает, что давление газа зависит только от числа молекул в объёме, но не от того, какие это молекулы. Поэтому для смеси различных газов можно записать
 ,
,
здесь P – давление смеси газов, P 1 P 2 P 3 …. – парциальные давления каждого из газов, входящих в смесь.
Давление смеси газов равно сумме их парциальных давлений – закон Дальтона.
3) Масса и размеры молекул.
Относительной атомной массой Аr элемента называется отношение массы атома этого элемента к 1/12 массы атома изотопа углерода 12С с массовым числом 12.
Относительной молекулярной массой Мr называется отношение массы молекулы этого вещества к 1/12 массы атома 12С. 1/12 массы атома 12С называется атомной единицей массы (а.е.м.). 1а.е.м. = 1,66·10–27 кг.
Количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг изотопа углерода 12С, называется молем. Это число частиц называется числом Авогадро  моль‑1.
моль‑1.
Массу одного моля называют молярной массой M. Очевидно, что: 
m 0 – масса молекулы вещества или атома элемента.
 кг/моль;
кг/моль; 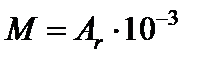 кг/моль.
кг/моль.
Найдем примерный размер молекулы. Моль воды имеет массу М = 18·10–3 кг; Объём моля 18·10–6 м3. Одна молекула занимает объём в NA раз меньший, то есть Vм ≈ 3·10‑30 м3, а ее линейный размер
 м
м
Молекулы других веществ имеют размеры того же порядка.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 340; Нарушение авторских прав?; Мы поможем в написании вашей работы!