
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
УРОВЕНЬ B. 1. При растворении в воде 8,15 г безводного ZnSO4 выделилось 3880 Дж, а при растворении в воде 35 г кристаллогидрата ZnSO4·6Н2О поглотилось 456 Дж
|
|
|
|
1. При растворении в воде 8,15 г безводного ZnSO4 выделилось 3880 Дж, а при растворении в воде 35 г кристаллогидрата ZnSO4·6Н2О поглотилось 456 Дж. Определить стандартную энтальпию образования кристаллогидрата из безводной соли и воды.
Дано:
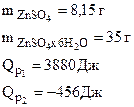
|
| DrHo(298K,ZnSO4·6Н2О) |
Процесс растворения безводного сульфата цинка в воде можно представить протекающим в две стадии:
1. ZnSO4(к)+6Н2О(ж) = ZnSO4·6Н2О(к), Dr.Ho(298K,4.3) (4.3)
2.ZnSO4·6Н2О(к) + nH2O(ж)=ZnSO4(р-р)+ (n+6)Н2О(ж),Dr.Ho(298K,4.4) (4.4)
где Dr.Ho(298K,4.3) - стандартная энтальпия образования кристаллогидрата из безводной соли и воды
Dr.Ho(298K,4.4) - стандартная энтальпия растворения кристаллогидрата
Суммарный процесс растворения безводной соли выразится сложением уравнений (4.3) и (4.4)
ZnSO4(к)+6Н2О(ж) + ZnSO4·6Н2О(к) + nH2O(ж)= ZnSO4·6Н2О(к) + + ZnSO4(р-р)+ (n+6)Н2О(ж)
После сокращения получаем
ZnSO4(к) = ZnSO4(р-р) Dr.Ho(298K,4.5) (4.5)
Согласно закона Гесса Dr.Ho(298K,4.5) = Dr.Ho(298K,4.3) + +Dr.Ho(298K,4.4)
Для нахождения стандартной энтальпии образования кристаллогидрата из безводной соли и воды (ур. 4.3) используем выражение
Dr.Ho(298K,4.3) = Dr.Ho(298K,4.5) - Dr.Ho(298K,4.4)
Таким образом, далее необходимо вычислить стандартные энтальпии растворения безводной соли (Dr.Ho(298K,4.5)) и кристаллогидрата (Dr.Ho(298K,4.4). Учитывая, что ∆Н = -Qp, то если Qp > 0, энергия выделяется (∆Н < 0), а если Qp< 0, то энергия поглощается (∆Н > 0)
Известно (см. задачу 3 уровня А), что

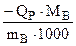 , (кДж/моль) (4.6)
, (кДж/моль) (4.6)
где Qp – тепловой эффект растворения вещества, Дж;
МВ - молярная масса вещества, г/моль,
mВ – масса вещества, г.
1000 - пересчет Дж в кДж.
 = 161,4 г/моль
= 161,4 г/моль
 = 161,4+6(2·1+16) = 269,4 г/моль
= 161,4+6(2·1+16) = 269,4 г/моль
Dr.Ho(298K,4.5) =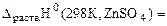
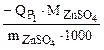 =
=
= 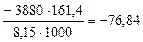 кДж/моль
кДж/моль
Dr.Ho(298K,4.4) =
=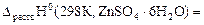
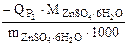 =
=
= 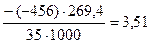 кДж/моль
кДж/моль
Откуда Dr.Ho(298K,4.3) = -76,84 – 3,51 = -80,35 кДж/моль
2. Используя справочные данные по DfHo(298K, В) и So(298K, В), вычислить изменение стандартной энергии Гиббса и определить возможность и направление протекания реакции при низких и высоких температурах
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2O(г)
| Дано: Уравнения реакции |
| DrGо(298К)-? условия протекания реакции -? |
РЕШЕНИЕ:
Возможность самопроизвольного протекания реакции, определяется знаком перед величиной изменения энергии Гиббса для данной реакции:
если ΔrG°(298К) < 0, самопроизвольное протекание реакции при стандартных условиях возможно в прямом направлении;
если ΔrG°(298К) > 0, то при стандартных условиях прямая реакция невозможна, а возможна обратная реакция..
Значение ΔrG°(298К) рассчитываем по формуле:
ΔrG°(298К) = ΔrН°(298К)·103 - Т ΔrS°(298К)
где ΔrН°(298К) - изменение стандартной энтальпии реакции, кДж: ΔrS°(298К) - изменение стандартной энтропии реакции, Дж/К:
103 - пересчет кДж в Дж.
Значение ΔrН°(298К) и ΔrS°(298К) определяем согласно первому следствию из закона Гесса:
ΔrН°(298К) = [2ΔfН°(298К, Fe(к)) + 3ΔfН°(298К, Н2О(г))] –
- [ΔfН°(298К, Fe2O3(к)) + 3ΔfН°(298К, Н2(г))];
ΔrS°(298К) = [2S°(298К, Fe(к)) + 3S°(298К, Н2О(г))] –
- [S°(298К, Fe2O3(к)) + 3S°(298К, Н2(г))];
где ΔfН°(298К, В) и S°(298К, В) - стандартные энтальпии образования и энтропии веществ, значения которых находим из таблицы стандартных термодинамических величин.
| Fe2O3(к) + | 3Н2(г) | = 2Fe(к) | + 3Н2О(г) | |
| DfHo(298K), кДж/моль | 1(-822,2) | 3(0) | 2(0) | 3(-241,84) |
| So(298 K), Дж/(моль×К) | 1(87,4) | 3(130.5) | 2 (27.15) | 3(188,74) |
ΔrН°(298К) = [2(0) + 3(-241,84)] - [(-822,2) + 3(0)] = 96,68 кДж
ΔrS°(298К) = [2·27,15 + 3·188,74] - [87,4 + 3·130,5] = 141,62 Дж/К
тогда:
ΔrGо (Т) = 96680 - Т·141,62
Ответ: При низких температурах значение ΔrGо (Т) > 0, сле-довательно прямой процесс запрещен, а при высоких температурах значение ΔrGо (Т) < 0 и, следовательно, возможен прямой процесс.
3. Рассчитать теплотворную способность каменного угля, если известно, что в нем содержится 80% углерода, а в отходящих газах после сгорания угля содержится 14% СО2 и 2% СО по объему.
Дано:
ωC = 80% масс.
ω = 14% об.
ω = 14% об.
ω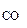 = 2 % об. = 2 % об.
|
| Qкаменного угля -? |
РЕШЕНИЕ:
Теплотворной способностью топлива называется тепловой эффект, который соответствует сгоранию единицы массы (1 кг) для твердых и жидких видов топлив (Qр, кДж/кг).
Приводим уравнения горения углерода
С(к) + О2(г) = СО2(г) (4.8)
С(к) + ½ О2(г) = СО(г) (4.9)
Из приведенных уравнений (ур. 4.8 и 4.9) следует, что масса сгоревшего углерода пропорционально объемам образовавшихся газов. Поскольку в каменном угле содержится 80% углерода, то в 1000 г каменного угля содержится 800 г углерода и в СО2 превратилось (ур 4.8)
 г углерода,
г углерода,
а в СО превратилось:  г углерода (ур. 4.8)
г углерода (ур. 4.8)
Исходя из того, что тепловые эффекты реакций (4.8) и (4.9) есть стандартные энтальпии образования СО2 и СО (величины табличные), но взятые с противоположным знаком, поскольку DН= - Qр
DfНo (298 K, СО2) = - 393,5 кДж/моль
и DfНo(298 K, СО) = - 110,5 кДж/моль
рассчитываем количество теплоты, выделившейся при сгорании 700 г углерода до СО2 (ур. 4.8). Молярная масса углерода МС = 12 г/моль.
При сгорании
12 г углерода выделяется 393,5 кДж
700 г углерода выделяется Qр(4.8) кДж
откуда:
Qр(4.7) 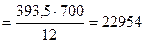 кДж
кДж
Рассчитываем количество теплоты, выделившейся при сгорании 100 г углерода до СО (ур.4.9).
при сгорании
12 г углерода выделяется 110,5 кДж
100 г углерода выделяется Qр(4.9) кДж
откуда:
Qр(4.9) 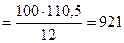 кДж
кДж
Следовательно теплотворная способность каменного угля Qр = Qр(4.8) + Qр(4.9) = 22954 + 921 = 23875 кДж/кг
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1405; Нарушение авторских прав?; Мы поможем в написании вашей работы!